
|
Виртуальная химическая школа |
|
Химия+методика+психология
ПериОДИЧЕСКИЙ ЗАКОН |
|
.
|





|
Группа элементов это вертикальная последовательность химических элементов в периодической системе. Каждая из групп имеет две подгруппы: главную и побочную. Элементы первых трех периодов относятся только к главным подгруппам. К главным подгруппам относятся также те элементы больших периодов (начиная с четвертого), которые расположены с той же стороны клеточки, как и элементы первых трех периодов. Так например, химический элемент калий (К), расположенный в четвертом периоде первой группе относится к главной подгруппе, а медь (Cu), расположенная в том же периоде и той же группе – к побочной. Рассмотрим два атома: атом водорода и атом лития (Li). Оба атома находятся в одной группе (I) и имеют по 1 электрону во внешнем электронном слое. Разница состоит в том, что у атома водорода внешний электрон находится на первом электронном слое, а у лития – на втором. Очевидно, что размер атома лития больше, чем атома водорода (рис. 3.3.) |

|
Рис. 3.3. Сравнение размеров атомов водорода и лития, расположенных в одной группе |
|
Таким образом в группах сверху вниз размеры атомов увеличиваются. С уменьшением размера атома увеличивается его способность притягивать не только свои электроны, но и принимать электроны от других атомов. Эта способность характеризует степень выраженности неметаллических свойств. Следовательно в периоде слева направо неметаллические свойства увеличиваются, а в группе сверху вниз уменьшаются. Металлические свойства понимаемые химиками как способность отдавать электроны изменяются с точностью наоборот. В периоде неметаллические свойства слева-направо уменьшаются, а в группе напротив увеличиваются. |
|
ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. МЕНДЕЛЕЕВА
"Свойства элементов, а потому и образуемых ими простых и сложных тел (веществ), стоят в периодической зависимости от их атомного веса".
Современная формулировка:
"свойства химических элементов (т.е. свойства и форма образуемых ими соединений) находятся в периодической зависимости от заряда ядра атомов химических элементов".
Физический смысл химической периодичности
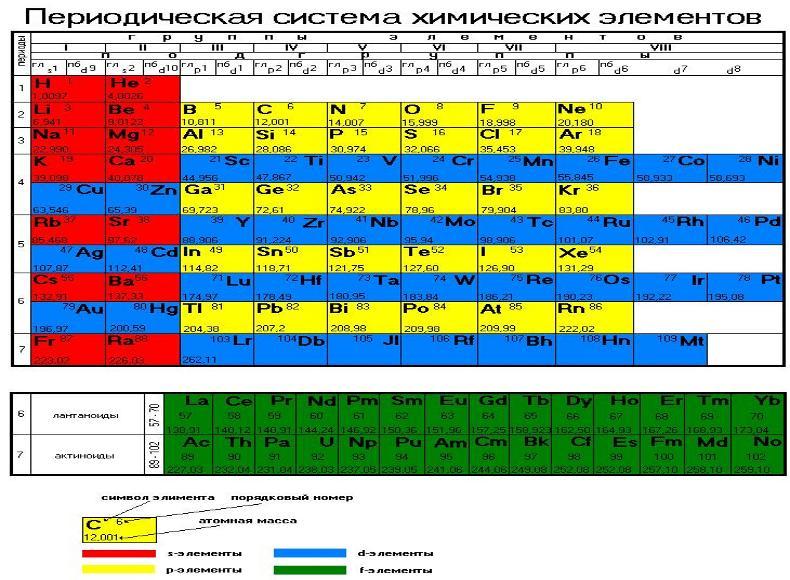
Периодические изменения свойств химических элементов обусловлены правильным повторением электронной конфигурации внешнего энергетического уровня (валентных электронов) их атомов с увеличением заряда ядра. Графическим изображением периодического закона является периодическая таблица. Она содержит 7 периодов и 8 групп.
Период - горизонтальные ряды элементов с одинаковым максимальным значением главного квантового числа валентных электронов. Номер периода обозначает число энергетических уровней в атоме элемента. Периоды могут состоять из 2 (первый), 8 (второй и третий), 18 (четвертый и пятый) или 32 (шестой) элементов, в зависимости от количества электронов на внешнем энергетическом уровне. Последний, седьмой период незавершен. Все периоды (кроме первого) начинаются щелочным металлом (s-элементом), а заканчиваются благородным газом (ns2 np6). Металлические свойства рассматриваются, как способность атомов элементов легко отдавать электроны, а неметаллические - присоединять электроны из-за стремления атомов приобрести устойчивую конфигурацию с заполненными подуровнями. Заполнение внешнего s- подуровня указывает на металлические свойства атома, а формирование внешнего p- подуровня - на неметаллические свойства. Увеличение числа электронов на p- подуровне (от 1 до 5) усиливает неметаллические свойства атома. Атомы с полностью сформированной, энергетически устойчивой конфигурацией внешнего электронного слоя (ns2 np6) химически инертны. В больших периодах переход свойств от активного металла к благородному газу происходит более плавно, чем в малых периодах, т.к. происходит формирование внутреннего (n - 1) d- подуровня при сохранении внешнего ns2 - слоя. Большие периоды состоят из четных и нечетных рядов. У элементов четных рядов на внешнем слое ns2 - электроны, поэтому преобладают металлические свойства и их ослабление с ростом заряда ядра невелико; в нечетных рядах формируется np- подуровень, что объясняет значительное ослабление металлических свойств.
Группы - вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Различают главные и побочные подгруппы. Главные подгруппы состоят из элементов малых и больших периодов, валентные электроны которых расположены на внешних ns- и np- подуровнях. Побочные подгруппы состоят из элементов только больших периодов. Их валентные электроны находятся на внешнем ns- подуровне и внутреннем (n - 1) d- подуровне (или (n - 2) f- подуровне). В зависимости от того, какой подуровень (s-, p-, d- или f-) заполняется валентными электронами, элементы периодической системы подразделяются на: s- элементы (элементы главной подгруппы I и II групп), p- элементы (элементы главных подгрупп III - VII групп), d- элементы (элементы побочных подгрупп), f- элементы (лантаноиды, актиноиды). В главных подгруппах сверху вниз металлические свойства усиливаются, а неметаллические ослабевают. Элементы главных и побочных групп сильно отличаются по свойствам. Номер группы показывает высшую валентность элемента (кроме O, F, элементов подгруппы меди и восьмой группы). Общими для элементов главных и побочных подгрупп являются формулы высших оксидов (и их гидратов). У высших оксидов и их гидратов элементов I - III групп (кроме бора) преобладают основные свойства, с IV по VIII - кислотные. |
|
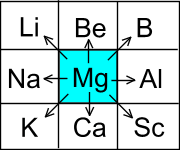
Для элементов главных подгрупп общими являются формулы водородных соединений. Элементы главных подгрупп I - III групп образуют твердые вещества - гидриды (водород в степени окисления - 1), а IV - VII групп - газообразные. Водородные соединения элементов главных подгрупп IV группы (ЭН4) - нейтральны, V группы (ЭН3) - основания, VI и VII групп (Н2Э и НЭ) - кислоты. От положения элементов в периодической системе зависят свойства атома, связанные с его электронной конфигурацией: атомный радиус - по периоду слева направо уменьшается, а в подгруппе сверху вниз возрастает; энергия ионизации - по периоду возрастает, а в подгруппе уменьшается; электроотрицательность - по периоду увеличивается, а в подгруппе уменьшается. По положению элемента в периодической системе можно прогнозировать его основные свойства как средние всех его соседей: |
ПримерНа основании периодической таблицы охарактеризуйте химические элементы с порядковыми номерами 21 и 34. Для характеристики химического элемента по периодической системе Д.И.Менделеева следует рассмотреть:
Положение в периодической таблице (порядковый номер; период, ряд; группа, подгруппа; атомная масса).
Строение атома (заряд ядра; состав ядра - количество протонов p11, нейтронов n01 и электронов ē; число энергетических уровней и подуровней; написать формулу электронной конфигурации; квантовые ячейки; по числу и характеру валентных электронов определить тип элемента).
Формулы и химический характер соединений (высшего оксида и гидроксида; водородных соединений).
Сравнить с соседями (по периоду, по группе).
Порядковый номер элемента Z = 21 обозначает: заряд ядра атома элемента (скандия): 6521Sc – +21; число протонов p11: 21Sc – 21 p11; число электронов ē: 21Sc – 21ē; число нейтронов n01 = Ar – Z = 65 – 21 = 44 – 44n10 Формула состава атома
Скандий находится в IV периоде; номер периода обозначает число энергетических уровней - 4. Скандий расположен в побочной подгруппе. Следовательно, его валентные электроны будут находится на 4s- и 3d-подуровнях.
Электронная формула скандия |
|
Скандий – d- элемент. Электронное строение атома заканчивается s- электронами, поэтому элемент будет проявлять металлические свойства. Формула высшего оксида – Sc2O3, гидроксида – Sc(OH)3 обладают слабыми основными свойствами. Соединений с водородом не образует.
Б) Порядковый номер 34 имеет селен Se. Элемент находится в IV периоде, значит в атоме имеется 4 энергетических уровня. Он находится в главной подгруппе VI группы; его валентные электроны распределены на 4s и 4p-подуровнях. Электронная формула селена: 34Se 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p4 Внешний уровень в виде квантовых ячеек имеет вид: |
|
Атом селена имеет 6 валентных электронов; поэтому высшая валентность равна 6, что соответствует номеру группы. Селен - p- элемент, поэтому будет проявлять свойства неметалла. Высший оксид SeO3, его гидроксид H2SeO4 и газообразное водородное соединение H2Se имеют кислотный характер. |
|
Периодический закон и периодическая система химических элементов Д.И. Менделеева. Радиусы атомов, их периодические изменения в системе химических элементов. Закономерности изменения химических свойств элементов и их соединений по периодам и группам. Периодический закон был открыт Д. И. Менделеевым в 1869 г. Приведу современную его формулировку«Свойства химических элементов и их соединений находятся в периодической зависимости от заряда ядра атомов». Это означает, что если расставить химические элементы в порядке возрастания ядра, то их свойства будут сначала постепенно изменяться, а затем через несколько элементов эти изменения будут повторяться. Причина этих изменений состоит в особенностях электронного строения атомов. Атом устроен таким образом, что электроны в нем расположены не беспорядочно, а послойно. В первом слое всего 2 электрона, следовательно химические свойства повторяются через 2 элемента (рис. 3.1. ). Во втором электронном слое может разместиться 8 электронов, поэтому химические свойства повторяются через 8 элементов. Дальше связь между максимальным числом электронов на уровне и повторяемостью свойств химических элементов становится более сложной, но свойства химических элементов также повторяются.
|
|
|
|
|
|
Рис. 3.1. Периодическая система химических элементов Д. И. Менделеева |
|
|
|
|
|
|
|
Д. И. Менделеев |
|
Рассмотрим элементы первого периода. Периоды - это горизонтальные последовательности химических элементов. И в атоме водорода (Н) и в атоме гелия (Не) все электроны находятся на первом электронном уровне. У атома водорода заряд ядра +1 и на первом электронном слое находится 1 электрон. У атома гелия заряд ядра +2, и на первом электронном слое находится 2 отрицательно заряженных электрона. Попробуем понять в каком случае притяжение между ядром и электронами будет сильнее. Логично, что 2 больше, чем один. Значит электроны в атоме гелия притягиваются сильнее. Это означает, что они будут ближе находиться к ядру. Следовательно размер гелия будет меньше (рис 3.2.), будет меньше и его радиус. Такая же закономерность будет повторяться в первом, втором и во всех последующих периодах. Это означает, что в периодах слева направо уменьшаются размеры атомов, а справа налево естественно увеличиваются. |
|
|
|
|
|
|
|
Рис. 3.2. Сравнение размеров водорода и гелия |
|
Группа |
I |
II |
III |
IV |
V |
VI |
VII |
VIII (кроме инертных газов) |
|
Высший оксид |
Э2О |
ЭО |
Э2О3 |
ЭО2 |
Э2О5 |
ЭО3 |
Э2О7 |
ЭО4 |
|
Гидрат высшего оксида |
ЭОН |
Э(ОН)2 |
Э(ОН)3 |
Н2ЭО3 |
Н3ЭО4 |
Н2ЭО4 |
НЭО4 |
Н4ЭО4 |
|
6521Sc ( |
21p11; 44n10 |
; 21ē) |
|
|
состав ядра |
|
|
21Sc |
1s2 2s2 2p6 3s2 3p6 |
3d1 4s2 |
|
|
|
|