|
АХМЕТОВ М. А. УРОК 10. ТЕОРИЯ. Выбрать другой урок http://maratakm.narod.ru
Характеристика переходных элементов – меди, хрома, железа по их положению в периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов.
Понятие переходный элемент обычно используется для обозначения любого из d- или f-элементов. Эти элементы занимают переходное положение между электроположительными s-элементами и электроотрицательными p-элементами. d-Элементы образуют три переходных ряда — в 4-м, 5-м и 6-м периодах соответственно. Первый переходный ряд включает 10 элементов, от скандия до цинка. Он характеризуется внутренней застройкой 3d-орбиталей. Хром и медь имеют на 4s-орбиталях всего по одному электрону. Дело в том, что полузаполненные или заполненные d-подоболочки обладают большей устойчивостью, чем частично заполненные. В атоме хрома на каждой из пяти 3d-орбиталей, образующих 3d-подоболочку, имеется по одному электрону. Такая подоболочка является полузаполненной. В атоме меди на каждой из пяти 3d-орбиталей находится по паре электронов (аналогичным образом объясняется аномалия серебра). Все d-элементы являются металлами. Большинство из них имеет характерный металлический блеск. По сравнению с s-металлами их прочность в целом значительно выше. В частности, для них характерны свойства: высокий предел прочности на разрыв; тягучесть; ковкость (их можно расплющить ударами в листы). Элемент Символ
d-элементы и их соединения обладают рядом характерных свойств: переменные состояния окисления; способность к образованию комплексных ионов; образование окрашенных соединений. d-Элементы характеризуются также более высокой плотностью по сравнению с другими металлами. Это объясняется сравнительно малыми радиусами их атомов. Атомные радиусы этих металлов мало изменяются в этом ряду. d-Элементы — хорошие проводники электрического тока, особенно те из них, в атомах которых имеется только один внешний s-электрон сверх полузаполненной или заполненной d-оболочки. Например, медь, . Химические свойства. Электроотрицательность и энергии ионизации металлов первого переходного ряда возрастают в направлении от хрома к цинку. Это означает, что металлические свойства элементов первого переходного ряда постепенно ослабевают в указанном направлении. Такое изменение их свойств проявляется и в последовательном возрастании окислительно-восстановительных потенциалов с переходом от отрицательных к положительным значениям. Хром — твердый голубовато-белый металл. При высоких температурах горит в кислороде с образованием Сr2О3, реагирует с парами воды 2 Сr + 3 Н2O и с галогенами, образуя галогениды состава СrНаl3. Хром (так же, как алюминий) пассивируется холодными концентрированными Н2SО4 и НNО3. Однако при сильном нагревании эти растворяют хром: 2 Сr + 6 Н2SО4(конц) = Сr2(SО4)3 + 3 SО2↑ + 6 Н2О, Сr + 6 НNО3(конц) = Сr(NО3)3 + 3 NO2↑ + 3 Н2О. При обычной температуре хром растворяется в разбавленных кислотах (НСl, Н2SО4) с выделением водорода, образуя Сr2+. По своим свойствам соли Сr2+ похожи на соли Fе2+. Обрабатывая их растворы щелочами, получают желтый осадок гидроксида хрома (II): СrСl2 + 2 NaОН = Сr(ОН)2↓ + 2 NaСl. При прокаливании Сr(ОН)2 в отсутствие кислорода образуется оксид хрома (II) СrО. Соли Cr3+ сходны с аналогичными солями алюминия. При действии щелочей на соли Сr3+ выпадает студнеобразный осадок гидроксида хрома (III) зеленого цвета: Сr2(SО4)3 + 6 NaОН = 2 Сr(ОН)3↓ + 3 Na2SО4, обладающий амфотерными свойствами. Он растворяется как в кислотах с образованием солей хрома (III) 2 Сr(ОН)3 + 3 Н2SО4 = Сr2(SО4)3 + 6 Н2О, так и в щелочах с образованием тетрагидроксихромитов, т.е. солей, в которых Сr3+ входит в состав аниона: Сr(ОН)3 + КОН = К[Cr(ОН)4]. В результате прокаливания Сr(ОН)3 получают оксид Сr2О3 - зеленые кристаллы, нерастворимые в воде. Этот оксид получают также прокаливанием дихроматов калия и аммония:
При сплавлении Сr2О3 со щелочами, содой и кислыми солями получаются соединения Сr+3, растворимые в воде: Сr2О3 + 2 NaОН = 2 NaСrО2 + Н2О↑, Сr2О3 + Nа2СО3 = 2 NaСrО2 + СО2↑, Сr2О3 + 6 КНSО4 = Сr2(SО4)3 + 3 К2SО4 + 3 Н2О. Наиболее важными соединениями хрома в высшей степени окисления +6 являются оксид хрома (VI) СrО3, хромат (VI) калия К2СrО4 и дихромат (VI) калия К2Сr2О7. Оксид хрома (VI) — ангидрид хромовой Н2СrО4 и дихромовой Н2Сr2О7 кислот, представляет собой ярко-красные кристаллы, растворимые в воде. Он также реагирует со щелочами, образуя желтые хроматы СrО42-: СrО3 + 2 КОН = К2СrО4 + Н2О. В кислой среде ион CrO42- превращается в ион Сr2О72- . В щелочной среде эта реакция протекает в обратном направлении:
Металлическое железо получают восстановлением его оксидов; реагируя с водяным паром, оно образует смешанный оксид железа (II, III) FеO.Fе2О3: 3 Fе + 4 Н2О(пар) На воздухе в присутствии влаги ржавеет: 4 Fе + 3 O2 + 6 Н2О = 4 Fе(ОН)3. С галогенами оно образует галогениды железа (III) 2 Fе + 3 Вr2 = 2 FеВr3, а взаимодействуя с соляной и разбавленной серной кислотами железа (II): Fе + Н2SО4 = FеSО4 + Н2↑. Концентрированные (НNО3, Н2SО4) пассивируют железо на холоде, однако растворяют его при нагревании: 2 Fе + 6 Н2SО4(конц) = Fе2(SО4)3 + 3 SО2↑ + 6 Н2О, Fе + 6 НNО3(конц) = Fе(NО3)3 + 3 NО2↑ + 3 Н2О. Растворимые соли железа в воде гидролизуются и дают кислую реакцию, поскольку железа (II) и (III) в воде не растворимы. Гидроксид железа (II) получают действием раствора щелочи на соли железа (II) без доступа воздуха: FеSО4 + 2 NaОН = Fе(ОН)2↓ + Na2SО4. Fе(ОН)2 — осадок белого цвета; в присутствии воздуха он быстро превращается в гидроксид железа (III) (бурый осадок): 4 Fе(ОН)2 + O2 + 2 Н2О = 4 Fе(ОН)3. Гидроксид железа (III), в отличие от Fе(ОН)2, амфотерен, при нагревании он способен растворяться в щелочах с образованием гексагидроферрата (III): Fе(ОН)3 + 3 КОН = К3[Fе(ОН)6] Это — один из анионных комплексов железа (III). Отметим еще две важные комплексные соли железа: гексацианоферрат (II) калия К4[Fе(СN)6] (желтая кровяная соль) и гексацианоферрат ( III) калия К3[Fе(СN)6] (красная кровяная соль), являющиеся реактивами для качественного определения ионов Fе3+ и Fe2+ соответственно. Добавление раствора гексацианоферрата (II) к растворам, в которых содержатся вызывает образование темно-синего осадка, часто называемого берлинской лазурью: 4 К4[Fе(СN)6] + 4 Fе3+ = 4 КFеIII[FеII(СN)6]↓ + 12 К+. (*) Такой же темно-синий осадок образуется при добавлении раствора гексацианоферрата (III) к растворам, содержащим ионы железа (II). В этом случае осадок называется турнбуллевой синью: 3 К3[Fе(СN)6] + 3 Fе2+ = 3 КFеII[FеIII(СN)6]↓ + 6 К+. (**) Установлено, что берлинская лазурь и турнбуллева синь — это одно и то же вещество, так как комплексы, образующиеся в реакциях (*) - (**) находятся между собой в равновесии: КFеIII[FеII(СN)6] Медь — довольно мягкий металл красно-желтого цвета, обладающий наименьшей активностью среди рассмотренных выше переходных металлов, которые вытесняют из растворов ее солей. Медь не реагирует с соляной и разбавленной серной кислотами и растворяется только в кислотах — окислителях: Сu + 2 Н2SО4(конц) = СuSО4 + SО2↑ + 2 Н2О, Сu + 4 НNO3(конц) = Сu(NО3)2 + 2 NО2↑ + 2 Н2О, 3 Cu + 8 НNО3(разб) = 3 Сu(NO3)2 + 2 NO↑ + 4 Н2О. Известны соединения меди со степенями окисления +1 и +2, из которых последние более устойчивы. Одновалентная медь образует либо нерастворимые Хлорид меди (I) растворяется в концентрированном растворе аммиака с образованием комплексной соли хлорида диамминмеди (I)[Сu(NН3)2]Сl; так же в аммиаке растворяется оксид меди (I): СuСl + 2 NН3 = [Сu(NН3)2]Сl, Сu2О + 4 NН3 + Н2О = 2[Сu(NН3)2]ОН. Ионы Сu2+ в водном растворе существуют в виде комплексов гексааквамеди (II) [Сu(Н2О)6]2+, придающих раствору сине-голубую окраску. При добавлении щелочи к такому раствору образуется голубой осадок гидратированного гидроксида меди (II): [Сu(Н2O)6]Сl2 + 2 NаОН = [Сu(ОН)2(Н2О)4]↓ + 2 NаСl + 2 Н2О. Полученный осадок, в свою очередь, растворяется в растворе аммиака, образуя ярко-синий комплекс. [Сu(ОН)2(Н2O)4] + 4 NН3 = [Сu(NН3)4(Н2О)2]2+ + 2 ОН- + 2 Н2О. Изменение окраски соединений меди при переходе из степени окисления +2 в Так, свежеосажденный Cu(ОН)2 голубого цвета восстанавливается альдегидами или углеводами (глюкозой) в желтый осадок гидроксида меди (I); последний даже при слабом нагревании распадается на воду и оранжевый оксид Сu2О. |

|
ГОТОВИМСЯ К ЕГЭ по ХИМИИ |
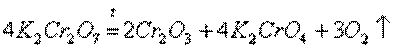
|
Элемент |
Символ |
Атомный номер |
Электронная конфигурация |
|||
|
Скандий |
Sc |
21 |
1s2 |
2s22p6 |
3s23p63d1 |
4s2 |
|
Титан |
Ti |
22 |
1s2 |
2s22p6 |
3s23p63d2 |
4s2 |
|
Ванадий |
V |
23 |
1s2 |
2s22p6 |
3s23p63d3 |
4s2 |
|
Хром |
Cr |
24 |
1s2 |
2s22p6 |
3s23p63d4 |
4s1 |
|
Марганец |
Mn |
25 |
1s2 |
2s22p6 |
3s23p63d5 |
4s2 |
|
Железо |
Fe |
26 |
1s2 |
2s22p6 |
3s23p63d6 |
4s2 |
|
Кобальт |
Co |
27 |
1s2 |
2s22p6 |
3s23p63d7 |
4s2 |
|
Никель |
Ni |
28 |
1s2 |
2s22p6 |
3s23p63d8 |
4s2 |
|
Медь |
Cu |
29 |
1s2 |
2s22p6 |
3s23p63d10 |
4s1 |
|
Цинк |
Zn |
30 |
1s2 |
2s22p6 |
3s23p63d10 |
4s2 |
|
Щелочная среда |
|
Кислая среда |
|
2 СrO2-4 + 2 H+ |
|
Cr2O2-7 + H2O |
|
|
|
|