|
АХМЕТОВ М. А. УРОК 2. ТЕОРИЯ. Выбрать другой урок http://maratakm.narod.ru СТРОЕНИЕ ЭЛЕКТРОННЫХ ОБОЛОЧЕК АТОМОВ ЭЛЕМЕНТОВ ПЕРВЫХ ЧЕТЫРЕХ ПЕРИОДОВ. ОСНОВНОЕ И ВОЗБУЖДЕННОЕ СОСТОЯНИЕ АТОМОВ.
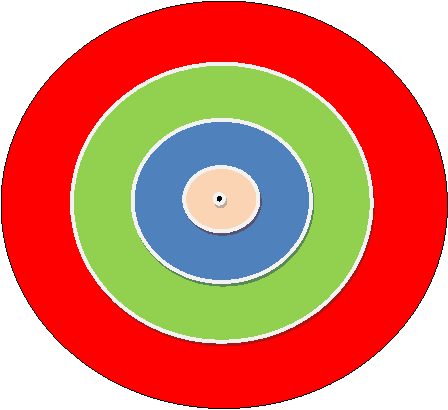
Прежде чем обсуждать строение электронных оболочек, необходимо разобраться в том, что такое электрон. Электрон можно представить как малую и очень подвижную частицу, имеющую отрицательный заряд. Величина этого заряда равна (-1). Электроны, удерживаемые положительно заряженным ядром атома или как мы еще говорим, входящие в состав ядра атома располагаются в определенной иерархии – слоями. Если мы представим себе слоеное пирожное шарообразной формы, то можем наверняка сказать, что во втором слое крема больше, чем в первом, а в третьем больше, чем во втором (рис. 2.1)
|

|
ГОТОВИМСЯ К ЕГЭ по ХИМИИ |
|
Рис 2.1. Модель, демонстрирующая увеличение объема слоев по мере удаления от ядра. |
|
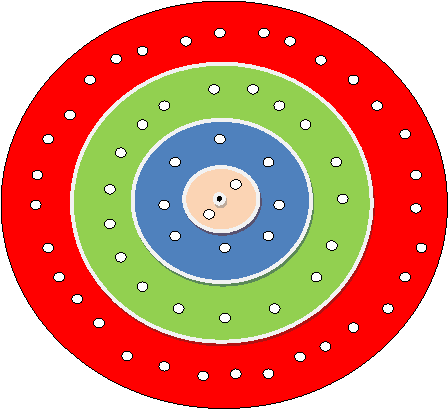
Если представить размещение электронов по слоям, то становится понятным, что в первом слое поместится меньше электронов чем в других слоях. Когда мы пытаемся представить размещение электронов, в атоме, то нужно еще учитывать, что электроны взаимно отталкиваются, и не могут находиться сколь угодно близко один от другого. Атом устроен таким образом, что в первом электронном слое могут расположиться только 2 электрона, во втором – 8 электронов, а в третьем – 18 электронов, на четвертом – 32. (рис. 2.2) |
|
Если присмотреться к электронным слоям, то можно обнаружить одну весьма любопытную закономерность. Первый электронный слой включает только один подуровень, тогда как второй состоит из двух. На третьем электронном слое три подуровня, а на четвертом – четыре. Эту закономерность очень легко запомнить (рис 2,3.).
|
|
Рис. 2.2. Модель, демонстрирующая связь удаленности электронного слоя от ядра атома с его емкостью. |

|
Каждый подуровень получил свое условное буквенное обозначение. Подуровень, который входит в состав всех уровней (обозначен самой тонкой полоской) получил обозначение s. Уровень, к которому относится электронный подуровень обозначается цифрой. 1s—это s-подуровень, относящийся к первому электронному уровню, 2s—это s-подуровень, относящийся ко второму электронному уровню и так далее . Подуровень, который впервые появляется на втором электронном уровне получил обозначение p. Принадлежность p-подуровня к электронному уровню также обозначается с помощью цифры. 2p—это p-подуровень, относящийся к второму электронному уровню. Начиная с третьего уровня появляется подуровень d, а начиная с четвертого—f (рис. 2.4.) |
|
Рис. 2.3. Деление электронных уровней на подуровни. Толщиной линии условно обозначена емкость подуровня |
|
Рис. 2.4. Условное обозначение электронных подуровней |
|
Е |

|
Толщиной линии каждого из подуровней условно обозначена их емкость. Максимальное число электронов, которые одновременно могут находиться на одном s-подуровне равно 2. На p-подуровне может находиться не более 6 электронов, на d-подуровне—не более 10 электронов, а на f-подуровне не более 18-ти (рис. 2.5. ) |

|
Рис. 2.5. Максимальное число электронов на каждом подуровне |
|
Каждый подуровень, в свою очередь состоит из орбиталей. На каждой из орбиталей, независимо от того, к какому электронному слою она принадлежит может находиться только по два электрона. Таким образом, на всех s-подуровнях только 1 орбиталь, на всех p-подуровнях – 3. На всех d-подуровнях – 5, а на f-подуровне – 7 (рис. 2.6. ) |

|
Рис. 2.6. Количество орбиталей на каждом электронном уровне |
|
Электроны заполняют орбитали подобно тому, как вода заполняет сосуд. Если орбитали имеют одинаковую энергию, то электроны вначале заполняют каждую из орбиталей по одному. В качестве иллюстрации рассмотри электронную конфигурацию атома азота в основном состоянии(рис 2.7) |
|
Рис. 2.7. Электронная конфигурация атома азота в основном состоянии. |
|
Электрон условно обозначен стрелочкой или ¯. Если электроны находятся на одной орбитали, то стрелочки разнонаправлены ¯, если электроны находятся по одному на каждой орбитали, то стрелочки однонаправлены Конфигурацию атома азота можно записать следующим образом 1s22s22p3. Большими цифрами обозначен номер электронного слоя, буквами – электронный подуровень, маленькими цифрами количество электронов на электронном подуровне. Если внимательно посмотреть на энергетическую диаграмму атома (рис 2.4.), то можно заметить, что постепенно разница в энергиях между уровнями уменьшается. Вследствие этого имеются некоторые исключения в правиле заполнения электронных слоев. Так например 19-й электрон, вместо того, чтобы занять позицию на 3d-подуровне, неожиданно занимает более высокую позицию 4s, так это происходит в атоме калия (рис.2.8). Это связано с взаимным отталкиванием электронов. |


|
Рис. 2.8. Электронная конфигурация атома калия 1s22s22p63s23p64s1 |
|
И только начиная со скандия Sc электроны начинают располагаться на 3d-подуровне. Электронная конфигурация скандия выглядит следующим образом 1s22s22p63s23p63d14s2. При заполнении 3d подуровня случаются так называемые провалы электронов. В четвертом периоде есть 2 химических элемента, у которых случились провалы электронов с 4s-подуровня на 3d. Так электронная конфигурация хрома Cr выглядит следующим образом 1s22s22p63s23p63d54s1. Вторым химическим элементом, имеющим провал электронов является медь Cu, ее электронная конфигурация записывается так 1s22s22p63s23p63d104s1. Все электронные конфигурации о которых мы говорили выше являются конфигурациями с наименьшей энергией или как их еще называют основные. При получении энергии извне, один либо несколько электронов могут повышать свою энергию, поднимаясь на более высокие энергетические состояния. Такие состояния атома называются возбужденными. Переход атома в возбужденное состояние происходит при облучении или нагревании вещества. Состояние которое требует для повышения энергии электрона наименьших энергетически затрат называют первым возбужденным состоянием. Возбужденное состояние атома является неустойчивым и через некоторое время электрон теряет энергию, перейдя на энергетическую орбиталь с меньшей энергией, испустив при этом квант света. Так к примеру электронную конфигурацию атома гелия в первом возбужденном состоянии можно записать так 1s12s1. Первое возбужденное состояние атома углерода 1s22s22p13s1. |