|
АХМЕТОВ М. А. УРОК 3. ТЕОРИЯ. Выбрать другой урок http://maratakm.narod.ru Периодический закон и периодическая система химических элементов Д.И. Менделеева. Радиусы атомов, их периодические изменения в системе химических элементов. Закономерности изменения химических свойств элементов и их соединений по периодам и группам. Периодический закон был открыт Д. И. Менделеевым в 1869 г. Приведу современную его формулировку «Свойства химических элементов и их соединений находятся в периодической зависимости от заряда ядра атомов». Это означает, что если расставить химические элементы в порядке возрастания ядра, то их свойства будут сначала постепенно изменяться, а затем через несколько элементов эти изменения будут повторяться. Причина этих изменений состоит в особенностях электронного строения атомов. Атом устроен таким образом, что электроны в нем расположены не беспорядочно, а послойно. В первом слое всего 2 электрона, следовательно химические свойства повторяются через 2 элемента (рис. 3.1. ). Во втором электронном слое может разместиться 8 электронов, поэтому химические свойства повторяются через 8 элементов. Дальше связь между максимальным числом электронов на уровне и повторяемостью свойств химических элементов становится более сложной, но свойства химических элементов также повторяются. |

|
ГОТОВИМСЯ К ЕГЭ по ХИМИИ |
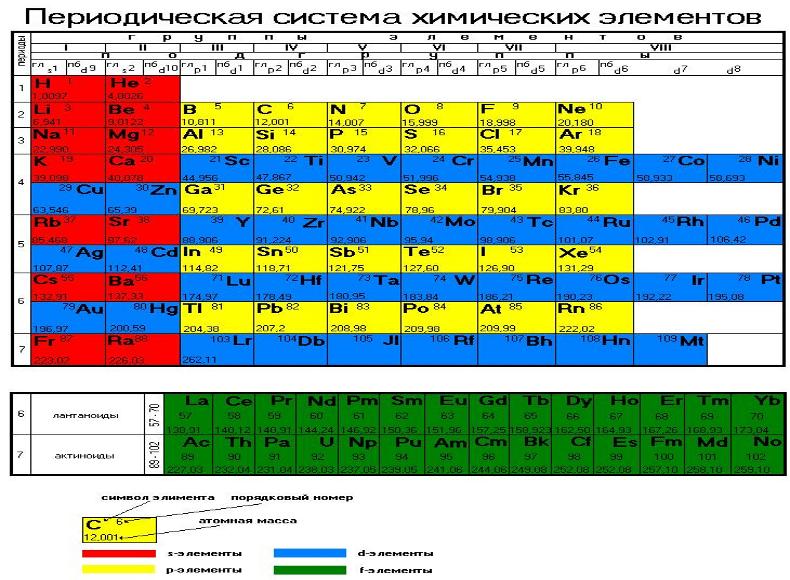
|
Рис. 3.1. Периодическая система химических элементов Д. И. Менделеева |
|
Рассмотрим элементы первого периода. Периоды - это горизонтальные последовательности химических элементов. И в атоме водорода (Н) и в атоме гелия (Не) все электроны находятся на первом электронном уровне. У атома водорода заряд ядра +1 и на первом электронном слое находится 1 электрон. У атома гелия заряд ядра +2, и на первом электронном слое находится 2 отрицательно заряженных электрона. Попробуем понять в каком случае притяжение между ядром и электронами будет сильнее. Логично, что 2 больше, чем один. Значит электроны в атоме гелия притягиваются сильнее. Это означает, что они будут ближе находиться к ядру. Следовательно размер гелия будет меньше (рис 3.2.), будет меньше и его радиус. Такая же закономерность будет повторяться в первом, втором и во всех последующих периодах. Это означает, что в периодах слева направо уменьшаются размеры атомов, а справа налево естественно увеличиваются.
|
|
Группа элементов это вертикальная последовательность химических элементов в периодической системе. Каждая из групп имеет две подгруппы: главную и побочную. Элементы первых трех периодов относятся только к главным подгруппам. К главным подгруппам относятся также те элементы больших периодов (начиная с четвертого), которые расположены с той же стороны клеточки, как и элементы первых трех периодов. Так например, химический элемент калий (К), расположенный в четвертом периоде первой группе относится к главной подгруппе, а медь (Cu), расположенная в том же периоде и той же группе – к побочной. Рассмотрим два атома: атом водорода и атом лития (Li). Оба атома находятся в одной группе (I) и имеют по 1 электрону во внешнем электронном слое. Разница состоит в том, что у атома водорода внешний электрон находится на первом электронном слое, а у лития – на втором. Очевидно, что размер атома лития больше, чем атома водорода (рис. 3.3.) |

|
Рис. 3.2. Сравнение размеров водорода и гелия |

|
Рис. 3.3. Сравнение размеров атомов водорода и лития, расположенных в одной группе. |
|
Таким образом в группах сверху вниз размеры атомов увеличиваются. С уменьшением размера атома увеличивается его способность притягивать не только свои электроны, но и принимать электроны от других атомов. Эта способность характеризует степень выраженности неметаллических свойств. Следовательно в периоде слева направо неметаллические свойства увеличиваются, а в группе сверху вниз уменьшаются. Металлические свойства понимаемые химиками как способность отдавать электроны изменяются с точностью наоборот. В периоде неметаллические свойства слева-направо уменьшаются, а в группе напротив увеличиваются. |

|
Д. И. Менделеев |