|
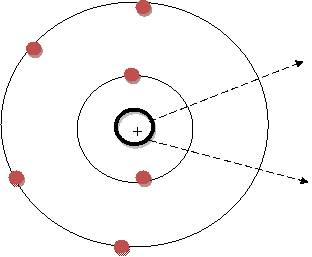
АХМЕТОВ М. А. УРОК 4. ТЕОРИЯ. Выбрать другой урок http://maratakm.narod.ru Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая, водородная. Теория химической связи – это раздел химии, в котором с химической точки зрения мы пытаемся объяснить почему атомы, ионы, молекулы собираются вместе, образуя более или менее устойчивые с течением времени группы атомов. Эта теория позволяет ответить на вопрос «Почему компьютер, перед экраном монитора которого вы сидите, не распадается на отдельные молекулы или атомы?» Причина наблюдаемого явления – электростатическое притяжение, ли проще говоря притяжение между положительным и отрицательным зарядами. Если атом имеет достаточную величину заряда и незаполненную электронную оболочку, то его ядро может притянуть дополнительные электроны (рис 4.1). |

|
ГОТОВИМСЯ К ЕГЭ по ХИМИИ |
|
Рис. 4.1. Модель, демонстрирующая способность ядра атома притягивать дополнительные электроны |
|
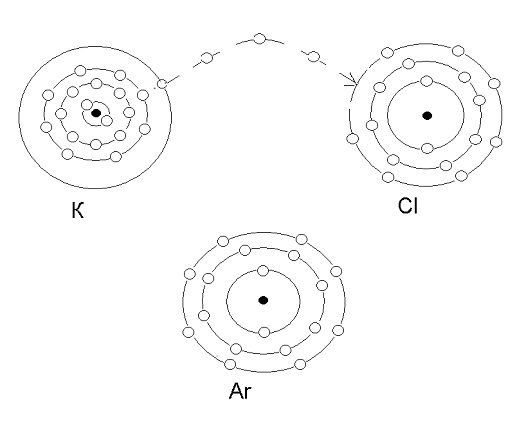
Таким образом один атом может притянуть электроны другого атома. Пусть в какой-то момент времени встретились два атома. Атом металла и атом неметалла. Так как атом неметалла способен притягивать электроны в большей степени, то он перетягивает электроны с внешнего электронного уровня атома металла к себе. Эти электроны от одного атома переходят к другому (рис. 4.2). |
|
Рис. 4.2. Переход электрона от атома калия (К) к атому хлора(Cl) |
|
При этом образуются заряженные частицы—ионы, притягивающиеся между собой. Предлагаю Вам посмотреть презентацию образование ионов. Так образуется ионная связь. Представьте атомы водорода, находящиеся на большом расстоянии друг от друга. Большое расстояние между атомами не позволяет атомам взаимодействовать (рис. 4.3.) |

|
Рис. 4.3. Отсутствие взаимодействия атомов нга большом расстоянии |
|
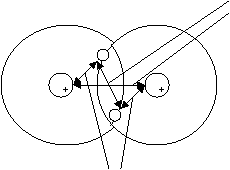
При сближении начинают действовать силы притяжения между ядром одного атома и электроном другого атома, а так же силы отталкивания между ядрами и между электронами (рис. 4.4.). Так образуется ковалентная связь |
|
Силы притяжения |
|
Силы отталкивания |
|
Рис. 4.4. Образование ковалентной связи на примере молекулы водорода |
|
Если общая электронная пара в равной степени принадлежит каждому из атомов, то связь ковалентная неполярная. А если электронная пара смещена к одному из атомов, то связь ковалентная полярная. Представьте себе, что когда два атома металла сближаются, орбитали их внешних оболочек перекрываются. Если подходит третий атом, его атомные орбитали могут перекрыться с орбиталями первых двух атомов. В случае большого числа атомов возникает большое число перекрытых орбиталей, простирающих во всех направлениях. Вследствие многократного перекрывания атомных орбиталей внешние электроны каждого атома испытывают влияние большого числа атомов. Они могут двигаться по всей решетке, т.е. не локализованы как прежде, во внешней оболочке какого-то атома: они делокализованы. При уходе электронов остаются катионы металла. Эти катионы не разлетаются вследствие отталкивания между ними, потому, что каждый катион притягивается делокализованным электронным облаком, заполняющим пространство между ними (рис. 4.5.)
|

|
Рис. 4.5. Схема образования металлической связи в кристалле металла |
|
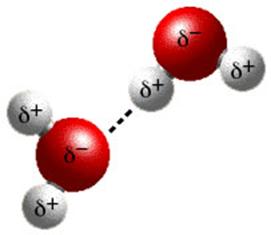
"Обобществленные" электроны передвигаются в пространстве между катионами и удерживают их вместе. Такая связь существует не только в твердых кристаллах металлов, но и в расплавах и в аморфном состоянии. Водородная связь образуется между атомами водорода, связанными с атомами сильных неметаллов, таких как кислород, азот, галогены. Это происходит вследствие сильной полярности связи Н–Эл в этих случаях (рис. 4.5) |
|
Рис. 4.5. Водородная связь между молекулами воды |