|
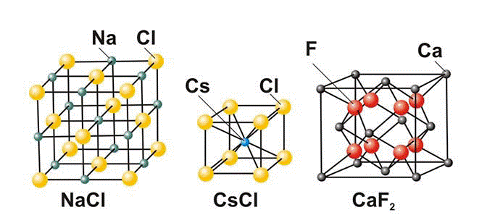
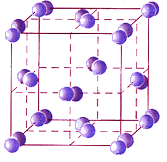
АХМЕТОВ М. А. УРОК 7. ТЕОРИЯ. Выбрать другой урок http://maratakm.narod.ru Вещества молекулярного и немолекулярного строения. Зависимость свойств веществ от особенностей их кристаллической решетки. Ранее мы познакомились со следующими видами химической связи: ионная, металлическая, ковалентная полярная и неполярная. Когда мы говорим о химической связи мы имеем ввиду то, как связаны атомы между собой. Когда мы говорим о кристаллической решетке и строении вещества, то имеется ввиду большая совокупность атомов. Говоря другими словами химическая связь – это микроуровень, а кристаллическая решетка – это макроуровень. Свойства вещества находятся в непосредственной зависимости от того, как организовано его строение на макроуровне или каким является его кристаллическая решетка. Вещества с ионной связью образуют ионную кристаллическую решетку. Вещества с ионной кристаллической решеткой имеют прочную химическую связь и как следствие имеют кристаллическое строение, высокие температуры плавления, многие из этих веществ относятся к электролитам.
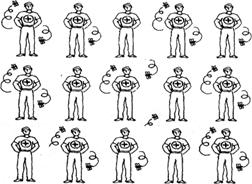
Рис. 7.1. Кристаллическая решетка ионных кристаллов Уподобим ионную структуру группе расположенных в шахматном порядке мужчин и женщин (рис. 7.2.). Пусть мужчины символизируют катионы, а женщины - анионы. Тогда каждый человек оказывается в зоне действия обаяния окружающих его представителей противоположного пола, к которым он (она) в силу закона притяжения противоположностей испытывает интерес. Интерес этот одинаково выражен во всех направлениях, поскольку на рисунке - холостые мужчины и незамужние женщины. Этим и объясняется повышенная прочность ионного кристалла.
Рис. 7.2. . Романтическая сила влечения – аналогия ионного кристалла. Вещества с металлической связью образуют металлическую кристаллическую решетку. Вещества с металлической решеткой являются электропроводными, имеют высокую теплопроводность, ковкие. S-металлы обычно имеют низкие температуры плавления, d-металлы – более высокие. Для иллюстрации строения металлов в твердом состоянии найдена особенно экстравагантная аналогия. Группа мужчин (рис. 7.3.) изображает катионы металлов (узлы металлической кристаллической решетки). Все пространство между ними заполнено летающими пчелами (это, понятно, свободные электроны). Рисунок убедительно иллюстрирует силы, удерживающие одноименно заряженные катионы в узлах решетки: при всем желании деваться некуда – всюду пчелы!
Рис. 7.3. Среди пчел (аналогия структуры металла), сравни с кристаллической структурой металла
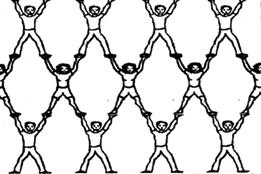
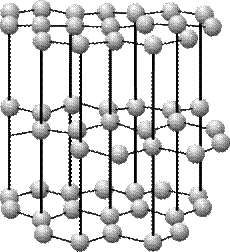
Вещества с ковалентной связью образуют два типа кристаллической решетки атомную и молекулярную. Вещества с атомной кристаллической решеткой имеют достаточно высокие температуры плавления, обладают высокой твердостью (кроме графита). Твердость – это способность к нанесению царапин. Вещества с атомной кристаллической решеткой химически инертны. В узлах атомной кристаллической решетки находятся атомы, связанные прочными ковалентными связями в протяженную пространственную сеть. В этом случае структура отличается таким внутренним единством, что можно сказать, что весь кристалл представляет одну молекулу. Представим эту структуру виде гимнастической пирамиды (рис. 7.4).
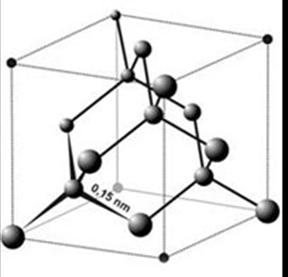
Рис. 7.4 Гимнастическая пирамида (аналогия атомного кристалла) Каждый гимнаст на ней символизирует атом углерода, связанный четырьмя ковалентными связями с соседними атомами. Целостность структуры поддерживается исключительно благодаря усилиям каждого из гимнастов. Таким образом, зависимость людей друг от друга в этой ситуации больше, чем на любом из предыдущих рисунков (это и является аналогией повышенной прочности атомного кристалла). Пирамида демонстрирует также высокую взаимосвязанность узлов атомной кристаллической решетки: стоит одному из гимнастов ослабить только одну связку, и вся структура может рухнуть. Наиболее известный из таких кристаллов - алмаз (рис. 7.5). Алмаз состоит только из одного элемента углерода - того же самого, из которого состоит обыкновенная сажа и графит. В алмазе каждый 4-х валентный атом углерода связан с другим атомом углерода чисто ковалентной связью и количество таких связанных в каркас атомов чрезвычайно велико. Алмаз можно было бы назвать гигантской молекулой, если бы к молекулам не предъявлялось требование иметь постоянный состав.
Рис. 7.5. Кристаллическая структура алмаза. В кристалле графита атомы углерода связаны несколько по-иному (рис. 7.6.). Они объединены в плоские слои, состоящие из правильных шестиугольников. Можно представить, что в этих шестиугольниках атомы углерода связаны между собой как простыми, так и двойными связями (двойные связи на рисунке не показаны). Расстояние между слоями в графите довольно велико, а силы взаимодействия между ними довольно слабы (в основном это слабые межмолекулярные связи, показанные пунктирными линиями), поэтому графит может расщепляться на тонкие чешуйки. Чешуйки легко прилипают к бумаге – вот почему из графита делают грифели карандашей.
Рис 7.6. Кристаллическая структура графита
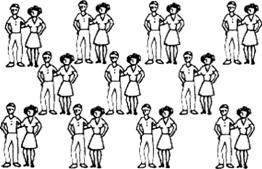
У веществ с молекулярным строением в узлах кристаллической решетки находятся молекулы с прочными ковалентными связями между атомами. В то же время отдельные молекулы взаимосвязаны гораздо слабее, что делает молекулярный кристалл довольно непрочным. Можно уподобить эту структуру группе семейных пар (рис. 7.7). В каждой паре супругов связывают прочные узы брака (подобно прочной связи атомов внутри молекулы), а вот отношения между парами носят поверхностный характер: они могут дружить семьями, испытывать дружеские чувства, но довольно свободно могут обойтись и друг без друга.
Рис. 7.7. Группа супружеских пар (аналогия молекулярного кристалла). Сравни с кристаллической решеткой йода.
|

|
ГОТОВИМСЯ К ЕГЭ по ХИМИИ |