|
АХМЕТОВ М. А. УРОК 8. ТЕОРИЯ. Выбрать другой урок http://maratakm.narod.ru
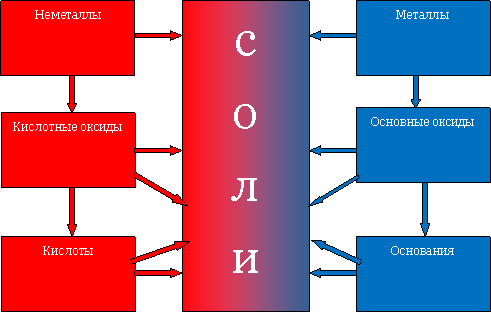
Многообразие неорганических веществ. Классификация неорганических веществ. В основе реакционной способности атомов лежит незаполненность их электронного слоя. Металлы в ходе химической реакции обычно отдают электроны, а неметаллы – принимают. Металлы вступают в реакцию с неметаллами с образованием солей, например 2Na+S=Na2S Металлы в реакциях с кислородом образуют обычно основные оксиды, например 4Na+O2=2Na2O. Неметаллы в реакциях с кислородом образуют кислотные оксиды, например S+O2=SO2. Основные оксиды реагируют с кислотными оксидами с образованием солей Na2O+SO2=Na2SO3. Основные оксиды реагируют с водой с образованием оснований, например, Na2O+H2O=2NaOH. Кислотные оксиды реагируют с водой с образованием кислот, например SO2+H2O=H2SO3. Основания реагируют с кислотами с образованием солей, например 2NaOH+H2SO3=Na2SO3+2H2O. Основные оксиды способны реагировать с кислотами, при этом образуются соли, например Na2O+H2SO3=Na2SO3. Кислотные оксиды реагируют с основаниями с образованием солей, например SO2+2NaOH=Na2SO3+H2O. Все вышесказанное удобно представить в виде схемы (рис 8.1).
Рис. 8.1. Направления реакционной способности основных классов неорганических веществ
Кроме того существуют амфотерные простые вещества, оксиды и гидроксиды. Амфотерными простыми веществами изучаемыми в школе являются бериллий Be, алюминий Al и цинк Zn. Амфотерные простые вещества реагируют как с кислотами, так и с основаниями. Например, Zn+2HCl=ZnCl2+H2 Zn+2KOH+2H2O=K2[Zn(OH)4]+H2. К амфотерным оксидам относят BeO, Al2O3, ZnO, H2O, Cr2O3, Fe2O3,. Амфотерные оксиды реагируют с кислотами и основаниями, а также основными и кислотными оксидами: ZnO+2HCl=ZnCl2+H2O ZnO+2KOH+H2O=K2[Zn(OH)4] SO3+H2O=H2SO4 K2O+H2O=2KOH. К амфотерным гидроксидам относят Be(OH)2, Zn(OH)2, Al(OH)3, Cr(OH)3, Fe(OH)3. Амфотерные гидроксиды реагируют с кислотами, основаниями, основными и кислотными оксидами: Zn(OH)2+2HCl=ZnCl2+2H2O Zn(OH)2+2KOH=K2[Zn(OH)4]+2H2O Zn(OH)2+SO3=ZnSO4+H2O Zn(OH)2+K2O=K2ZnO2+H2O Наибольшую реакционную способность проявляют типичные металлы и их соединения, и типичные неметаллы и их соединения. К типичным металлам относятся щелочные металлы, а также барий, стронций кальция. Активность всех остальных металлов и их соединений снижена, так магний вступает в химическую реакцию только с кипящей водой и нагретыми парами воды, а оксид магния не реагирует с водой. Медь к примеру не реагирует с кислотами (не может быть окислена ионом водорода). Примерно тоже самое можно сказать о неметаллах. Наибольшую активность проявляют фтор, кислород, галогены. Соли разделяются на растворимые в воде и нерастворимые в воде. О растворимости солей можно узнать из таблицы растворимости. Хорошо растворимы обычно соли щелочных металлов и аммония. Средние соли состоят только из остатка кислоты и основания, например CaSO4, Ba(NO3)2. Кислые соли кроме катиона металла содержат катион водорода, следовательно они проявляют все свойства солей и кислот, например Ca(HCO3)2+Сa(OH)2= 2CaCO3+2H2O Основные соли включают в свой состав также гироксильную группу и проявляют свойства солей и оснований, например (MgOH)2SO4+H2SO4=2MgSO4+2H2O. Основания делятся на растворимые в воде и нерастворимые в воде. Растворимые основания называют щелочами. Щелочами являются гидроксиды щелочных металлов, а также гидроксиды барии, стронция кальция. Все изучаемые в школе кислоты, кроме кремниевой растворимы в воде . Кислоты можно разделить на сильные и слабые. Следует запомнить сильные кислоты – это азотная HNO3, серная H2SO4, хлорная HClO4, хлороводородная (соляная) HCl, бромоводородная HBr, йодоводородная HI.
|

|
ГОТОВИМСЯ К ЕГЭ по ХИМИИ |