
|
Рис. 1. 1. Древнегреческий философ Демокрит
По Демокриту, существуют только атомы и пустота. Атомы бывают разных видов. Вид атома называют – ХИМИЧЕСКИМ ЭЛЕМЕНТОМ. Предполагается (согласно принципу минимума энергии), что атом должен иметь шарообразную форму (рис. 1.2) |

|
Рисунок 1.2. Модели атомов разных химических элементов.
В настоящее время известно более 110 химических элементов (видов атомов). Согласно современным представлениям атомы имеют сложное строение. Они состоят из ядра и электронов. Ядро почти в 2000 раз тяжелее атома. Но при этом оно примерно в 50000 раз меньше атома. То есть ядро атома очень маленькое и очень тяжелое (рис. 1.3)
|
|
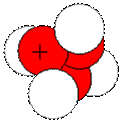
Рисунок 1.3. Модель, отражающая сложное строение атома. Если мысленно увеличить масштаб и представить, что ядро атома имеет диаметр 2 см, тогда радиус атома составил бы приблизительно 500 м. Как выяснили ученые, ядро тоже имеет сложное строение. Оно состоит, главным образом, из двух видов частиц протонов и нейтронов. Протоны имеют заряд +1 и массу, приблизительно равную 1 (в атомных единицах массы, а.е.м.). А.е.м. – величина очень удобная для измерения массы частиц микромира. Нейтрон (о чем можно догадаться по его названию) не имеет заряда, а его масса тоже примерно равна 1 а.е.м. Число протонов в ядре соответствует порядковому номеру химического элемента. Так если в ядре атома один протон, то это химический элемент с порядковым номером 1, то есть водород (Н). Заряд ядра атома водорода равен +1. Если в ядре атома 2 протона, то заряд ядра равен +2, и это второй по счету химический элемент – гелий (He). При наличии в ядре трех протонов, ядро атома имеет заряд ядра +3, его порядковый номер равен трем и это, соответственно литий (Li) так далее (см. табл. Д. И. Менделеева). Количество нейтронов в ядре может отличаться от количества протонов. Обычно (за исключением водорода) количество нейтронов равно числу протонов или чуть больше. При одном количестве протонов в ядре, количество нейтронов может быть различным. Так если в ядре находится один протон (атом водорода), при нем может быть ни одного протона, один и даже два (см. рис. 1.4 и таблицу 1.1 ). |


|
Рисунок 1.4. Визуальные модели ядер изотопов водорода |



|
Атомы, имеющие одинаковое число протонов в ядре (относящиеся к одному химическому элементу), но разное число нейтронов по отношению друг к другу являются ИЗОТОПАМИ.
Найдем в периодической системе Д. И Менделеева химический элемент под номером 3 – это литий Li. 3 – это порядковый номер, это значит, что заряд ядра равен +3. Найдем значение атомной массы (6,939) и округлим его, получим 7. Скорее всего, что его наиболее распространенный изотоп будет иметь массу равную 7. Следовательно в ядре этого изотопа будет находиться нейтрона (7–3=4) (рис. 1.5) |
|
Таблица 1.1. Визуальные модели ядер изотопов водорода |
|
Рис. 1.5. Визуальное представление ядра атома лития. Состав ядра атома записывают с помощью условных обозначений
Где p—число протонов, n– число нейтронов. p+n – сумма числа протонов и нейтронов. Число размещенное в левом нижнем углу от знака химического элемента показывает число протонов в его ядре (заряд ядра, порядковый номер химического элемента). Число размещенное в левом верхнем углу – это массовое число. Оно представляет собой сумму числа протонов и нейтронов в ядре. Если известно массовое число и порядковый номер химического элемента, то можно найти число нейтронов в ядре. Для этого от p+n нужно отнять p, останется n. В периодической системе (например у водорода 1,000797) обозначено массовое число химического элемента с учетом распространения в природе. Это означает, что несмотря на то, что у водорода три изотопа протий дейтерий и тритий основным природным изотопом водорода является протий, поэтому масса водорода близка к 1. Что такое модель? К сведению. Сегодня мы познакомились с моделями атомов. Модели – это наше мысленное представление о каком-либо явлении, объекте. Любые наши мысленные модели отражают лишь часть явления, объекта, какую-то его одну сторону. Ни одна из существующих моделей не способна описать полностью существующее явление (объект). Поэтому в зависимости от решаемых задач можно использовать разные модели. Часто мы рассматриваем атом как неделимую частицу, и этого для решения многих задач оказывается вполне достаточно. Но для того, чтобы понять, чем один химический элемент отличается от другого, или разобраться, что такое изотопы мы используем другую модель, согласно которой атом имеет сложное строение. Рекомендации по запоминанию. Химики, как правило имеют визуальное представление об изучаемых объектах и явлениях. Когда нам говорят «химический элемент», то мы представляем в своем сознании (мысленно видим) группы атомов, имеющих равное количество протонов в своем ядре. Когда нам говорят «изотопы» мы видим атомы, имеющие ядра с равным количеством протонов, но число нейтронов различно. Химические элементы – атомы с одинаковым количеством протонов в ядре могут группироваться вместе и образовывать между собой химические связи: по 2, 3, 8 или агрегируясь в более сложные структуры. В этом случае мы имеем дело с простым веществом. Если атомы одного химического элемента находятся в непосредственной близости от атомов другого элемента (других элементов), образуя с ними химические связи, то мы, скорее всего, имеем дело со сложным веществом. В сложном веществе атомы разных химических элементов обычно находятся друг к другу в постоянном соотношении, как небольшие целые числа (1:1, 1:2, 1:3, 2:3, 2:1:3 и т.п.) Когда мы говорим о химическом элементе, то можем иметь одну из форм его существования: форму простого вещества или форму химического элемента. Если химический элемент окружен атомами другого элемента, то речь идет о химическом элементе как составной части сложного вещества. Если химический элемент окружен такими же атомами, то чаще всего речь идет о простом веществе. Например, говоря фразу «Кислород –составная часть земной атмосферы, то мы имеем ввиду простое вещество». Говоря фразу «Кислород – главный компонент земной коры», мы имеем ввиду химический элемент. Понимая, что в составе земной коры вряд ли имеется газообразный кислород.
|

|
ПРОТОН |
НЕЙТРОН |
|
|
|
|
Характеристика ядер |
Протий |
Дейтерий |
Тритий |
|
|
|
|
|
|
Заряд |
+1 |
+1 |
+1 |
|
Масса, а.е.м. |
1 |
2 |
3 |