АХМЕТОВ М. А. УРОК 9. ЗАДАНИЯ Выбрать другой урок
Общая характеристика металлов главных подгрупп I—III групп в связи с их положением в периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов
1. Запишите уравнение реакции кальция с водой.
2. Какой из металлов натрий или литий более интенсивно реагирует с водой?
3. Почему алюминий не реагирует с водой?
4. Реагирует ли оксид кальция с водой?
5. Может ли оксид кальция вступить в реакцию с оксидом калия?
ТЕСТОВЫЕ ЗАДАНИЯ
А1. Какой металл имеет плотность меньше плотности воды?
|
1)
|
натрий
|
|
2)
|
рубидий
|
|
3)
|
кальций
|
|
4)
|
цезий
|
А2. Металл, реагирующий с азотом при комнатной температуре
|
1)
|
литий
|
|
2)
|
натрий
|
|
3)
|
калий
|
|
4)
|
рубидий
|
А3. Щелочные металлы
|
1)
|
проявляют как окислительные, так и восстановительные свойства
|
|
2)
|
легко принимают электроны
|
|
3)
|
легко отдают и принимают электроны
|
|
4)
|
окисляются при комнатной температуре на воздухе
|
А4. В реакциях щелочных металлов с водой образуются
|
1)
|
оксид металла и вода
|
|
2)
|
оксид металла и водород
|
|
3)
|
гидроксид металла и вода
|
|
4)
|
гидроксид металла и водород
|
А5. Натрий в реакции с большим избытком фосфорной кислоты образует
|
1)
|
фосфат натрия
|
|
2)
|
гидрофосфат натрия
|
|
3)
|
дигидрофосфат натрия
|
|
4)
|
смесь гидрофосфата и дигидрофосфата натрия
|
А6. Гидроксид калия реагирует в водном растворе с
|
1)
|
хлоридом калия
|
|
2)
|
хлоридом натрия
|
|
3)
|
хлоридом магния
|
|
4)
|
хлоридом бария
|
А7. Легче других отдает электрон с внешнего электронного уровня
|
1)
|
литий
|
|
2)
|
натрий
|
|
3)
|
калий
|
|
4)
|
рубидий
|
А8. Выберите верную характеристику «Щелочные металлы….»
|
1)
|
тугоплавкие и тяжелые
|
|
2)
|
тугоплавкие и легкие
|
|
3)
|
легкоплавкие и тяжелые
|
|
4)
|
легкоплавкие и легкие
|
А9. Как щелочные металлы реагируют с водой?
|
1)
|
практически с ней не реагируют за счет пассивации поверхности
|
|
2)
|
бурно реагируют с водой с выделением водорода
|
|
3)
|
реагируют с водой при повышении температуры
|
|
4)
|
реагируют с водой только при добавлении кислоты
|
А10. Реакция, протекание которой маловероятно
|
1)
|
2Na+2H2O=2NaOH+H2
|
|
2)
|
NaCl+H2O=NaOH+HCl
|
|
3)
|
Ca(OH)2+Na2CO3=2NaOH+CaCO3
|
|
4)
|
Na2O+H2O=2NaOH
|
А11. Формула кальцинированной соды
|
1)
|
CaSO4·2H2O
|
|
2)
|
CaCO3
|
|
3)
|
NaHCO3
|
|
4)
|
Na2CO3·10H2O
|
А12. Самовозгорается на воздухе
|
1)
|
литий
|
|
2)
|
натрий
|
|
3)
|
рубидий
|
|
4)
|
цезий
|
А13. Калий не реагирует с
|
1)
|
этанолом
|
|
2)
|
этиленгликолем
|
|
3)
|
жидким аммиаком
|
|
4)
|
бензолом
|
А14. В реакции натрия с 2-хлорпропаном образуется
|
1)
|
н-гексан
|
|
2)
|
2-метилпентан
|
|
3)
|
2,3-диметилбутан
|
|
4)
|
2,2-диметилбутан
|
А15. Соединению MgCO3·CaCO3 соответствует название минерала
|
1)
|
кальцит
|
|
2)
|
доломит
|
|
3)
|
ангидрит
|
|
4)
|
магнезит
|
А16. Формула гашенной извести
|
1)
|
Са(ОН)2
|
|
2)
|
СаО
|
|
3)
|
СаSO4·0,5H2O
|
|
4)
|
СаSO4·2 H2O
|
А17. Формула наиболее сильного основания
|
1)
|
Be(OH)2
|
|
2)
|
Mg(OH)2
|
|
3)
|
Ca(OH)2
|
|
4)
|
Ba(OH)2
|
А18. Реагирует с водой при комнатной температуре
|
1)
|
бериллий
|
|
2)
|
магний
|
|
3)
|
кальций
|
|
4)
|
цинк
|
А19. В ряду химических элементов
Ba®Sr®Ca®Mg металлические свойства
|
1)
|
ослабевают
|
|
2)
|
усиливаются
|
|
3)
|
изменяются периодически
|
|
4)
|
не изменяются
|
А20. Кальций в промышленности получают
|
1)
|
электролизом расплава CaCl2
|
|
2)
|
восстановлением Са из CaCl2 действием водорода
|
|
3)
|
восстановлением Са из CaCl2 действием кокса
|
|
4)
|
действием натрия на водный раствор хлорида кальция
|
А21. Разлагается действием воды
|
1)
|
сульфид кальция
|
|
2)
|
сульфат кальция
|
|
3)
|
фосфат кальция
|
|
4)
|
карбонат кальция
|
А22. При взаимодействии водных растворов хлорида кальция и карбоната калия в осадок выпадает
|
1)
|
оксид кальция
|
|
2)
|
гидроксид кальция
|
|
3)
|
карбонат кальция
|
|
4)
|
гидрокарбонат кальция
|
А23. Продуктом реакции углерода с кальцием является
|
1)
|
карбид кальция
|
|
2)
|
карбонат кальция
|
|
3)
|
карбонад кальция
|
|
4)
|
карбонит кальция
|
А24. Гидроксид бария взаимодействует с каждым из веществ группы
|
1)
|
Н2SO4, H2, H3PO4
|
|
2)
|
SO2, HNO3, Mg
|
|
3)
|
SO3, NaOH, Fe(OH)3
|
|
4)
|
SO2, HCl, NO2
|
А25. В схеме превращений K2CO3 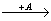 BaCO3
BaCO3 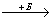 Ba(HCO3)2
Ba(HCO3)2
буквами «А» и «Б» обозначены вещества
|
1)
|
А – ВаО, Б – HBr
|
|
2)
|
А – Ва(ОH)2, Б – NaBr
|
|
3)
|
А – ВаCl2, Б – CO2 и Н2О
|
|
4)
|
А – ВаСl2, Б – NaOH
|
А26. Металл, который в реакции с водой образует оксид
|
1)
|
магний
|
|
2)
|
кальций
|
|
3)
|
стронций
|
|
4)
|
барий
|
А27. Известковая вода – это
|
1)
|
раствор гидроксида кальция в воде
|
|
2)
|
раствор гидрокарбоната кальция в воде
|
|
3)
|
раствор хлорида кальция в воде
|
|
4)
|
раствор нитрата кальция в воде
|
А28. Выберите верную характеристику алюминия
|
1)
|
легкий серебристый металл
|
|
2)
|
твердый серебристый металл
|
|
3)
|
легкий очень прочный металл
|
|
4)
|
металл, обладающий высокой твердостью
|
А29. Третий элемент по распространенности в литосфере Земли
А30. Гидроксид алюминия реагирует с водным раствором
|
1)
|
K2CO3
|
|
2)
|
NaCl
|
|
3)
|
С2Н5ОН
|
|
4)
|
KNO3
|
А31. В алюминиевой посуде нельзя хранить квашенную капусту (и другие кислые продукты), готовить мясо для шашлыка с добавлением уксусной кислоты, потому что
|
1)
|
алюминий катализирует гниение кислых продуктов
|
|
2)
|
алюминий взаимодействует с кислотой
|
|
3)
|
алюминий реагирует с веществами, входящими в состав этих продуктов
|
|
4)
|
поверхность посуды вследствие действия на нее кислоты покрывается пленкой органических солей алюминия
|
А32. Ошибочная характеристика алюминия
|
1)
|
алюминий – серебристо-белый металл, обладающий достаточно высокой электропроводностью
|
|
2)
|
плотность алюминия, примерно втрое меньше плотности железа
|
|
3)
|
алюминий – достаточно прочный металл, особенно в сплавах
|
|
4)
|
алюминий – очень хрупкий металл
|
А33. Наиболее бурно происходит реакция соляной кислоты с гранулами
|
1)
|
алюминия
|
|
2)
|
цинка
|
|
3)
|
магния
|
|
4)
|
олова
|
А34. При контакте металлических изделий с ртутью происходит их растворение в ртути, с образованием сплавов, называемых амальгамами. Амальгамированный алюминий реагирует с
|
1)
|
водой
|
|
2)
|
бензолом
|
|
3)
|
спиртом
|
|
4)
|
жидким аммиаком
|
А35. Чтобы усилить гидролиз хлорида алюминия к его водному раствору нужно добавить
|
1)
|
хлорид натрия
|
|
2)
|
карбонат натрия
|
|
3)
|
хлорид аммония
|
|
4)
|
нитрат калия
|
А36. В промышленности получают алюминий электролизом расплава оксида алюминия в криолите. Проводить электролиз чистого оксида алюминия невозможно, так как оксид алюминия
|
1)
|
слишком дорогой
|
|
2)
|
очень тугоплавкое вещество
|
|
3)
|
очень твердое вещество
|
|
4)
|
слабый электролит и очень тугоплавкое вещество
|
А37. В ряду элементов Al®Mg®Na уменьшается
|
1)
|
атомный радиус
|
|
2)
|
восстановительная способность
|
|
3)
|
химическая активность
|
|
4)
|
электроотрицательность
|
А381. Все элементы главной подгруппы III группы имеют электронную конфигурацию
|
1)
|
ns2np1
|
|
2)
|
ns2
|
|
3)
|
ns2np6
|
|
4)
|
ns2np7
|
А39. Алюминий реагирует с водным раствором гидроксида натрия. При этом образуется
|
1)
|
NaAlO2 + H2
|
|
2)
|
NaAlO2 + H2O
|
|
3)
|
Na[Al(OH)4] + H2
|
|
4)
|
Na[Al(OH)4] + H2O
|
А40. К четырем пробиркам, содержащим растворы солей, добавили раствор гидроксида натрия. В одной из пробирок сначала выпал осадок, но при дальнейшем добавлении раствора щелочи он растворился. Какое вещество находилось в исследуемой пробирке
|
1)
|
AlCl3
|
|
2)
|
NaCl
|
|
3)
|
MgCl2
|
|
4)
|
Fe(NO3)3
|
А41. Через водный раствор тетрагидрксоалюмината натрия пропустили газ. При этом наблюдали выпадение осадка. Этот газ –
|
1)
|
H2
|
|
2)
|
CH4
|
|
3)
|
NH3
|
|
4)
|
CO2
|
А42. Из приведенных утверждений
А. Бор имеет более выраженные металлические свойства, чем алюминий
Б. Хлор ярче проявляет неметаллические свойства, чем фосфор
|
1)
|
верно только А
|
|
2)
|
верно только Б
|
|
3)
|
верны оба суждения
|
|
4)
|
оба суждения неверны
|
А43. Алюминий в отличие от бора
|
1)
|
при нагревании реагирует с кислородом
|
|
2)
|
при комнатной температуре реагирует со фтором
|
|
3)
|
химически инертен
|
|
4)
|
хорошо проводит электрический ток
|
А44. Алюминий – весьма активный металл, однако он не реагирует с водой. Это объясняется тем, что…
|
1)
|
на поверхности алюминия под воздействием атмосферного воздуха образуется химически инертная пленка оксида алюминия
|
|
2)
|
на поверхности алюминия под воздействием воды образуется химически инертная пленка гидроксида алюминия
|
|
3)
|
на поверхности алюминия под воздействием атмосферного воздуха образуется химически инертная пленка гидроксида алюминия
|
|
4)
|
на поверхности алюминия под воздействием воды образуется химически инертная пленка оксида алюминия
|
А45. Алюминий не реагирует с
|
1)
|
соляной кислотой
|
|
2)
|
раствором гидроксида натрия
|
|
3)
|
раствором сульфата натрия
|
|
4)
|
раствором уксусной кислотой
|
А46. Верно, что гидроксид алюминия
|
1)
|
окисляется на воздухе
|
|
2)
|
не растворяется в водных растворах щелочей
|
|
3)
|
не растворяется в водных растворах кислот
|
|
4)
|
разлагается при нагревании
|
А47. При сплавлении гидроксида натрия с оксидом алюминия образуется вещество, формула которого
|
1)
|
NaAlO2
|
|
2)
|
NaAlO3
|
|
3)
|
Na2AlO3
|
|
4)
|
Na3AlO3
|
А48. Наиболее вероятно, что при действии избытка концентрированного водного раствора гидроксида натрия на гидроксид алюминия образуется
|
1)
|
Na[Al(OH)4]
|
|
2)
|
Na2[Al(OH)5]
|
|
3)
|
Na3[Al(OH)6]
|
|
4)
|
Na[Al(H2O)2(OH)4]
|
В1. Установите соответствие между металлом и его температурой плавления
|
|
МЕТАЛЛ
|
|
ТЕМПЕРАТУРА ПЛАВЛЕНИЯ, 0С
|
|
А)
|
литий
|
1)
|
97,8
|
|
Б)
|
натрий
|
2)
|
63,7
|
|
В)
|
калий
|
3)
|
39,1
|
|
Г)
|
рубидий
|
4)
|
180,5
|
|
|
|
В2. Установите соответствие между ионом и окраской пламени
|
|
ИОН МЕТАЛЛА
|
|
ЦВЕТ ПЛАМЕНИ
|
|
А)
|
Na+
|
1)
|
фиолетовый
|
|
Б)
|
K+
|
2)
|
красный
|
|
В)
|
Rb+
|
3)
|
малиновый
|
|
Г)
|
Ba2+
|
4)
|
зеленый
|
|
|
|
5)
|
желтый
|
В3. Установите соответствие между солями кальция и продуктами их разложения при нагревании
|
|
ВЕЩЕСТВО
|
|
ПРОДУКТЫ РАЗЛОЖЕНИЯ
|
|
А)
|
гидрокарбонат кальция
|
1)
|
карбонат кальция + ацетон
|
|
Б)
|
ацетат кальция
|
2)
|
карбонат кальция + углекислый газ + вода
|
|
В)
|
нитрат кальция
|
3)
|
карбонат кальция + формальдегид
|
|
Г)
|
формиат кальция
|
4)
|
оксид кальция + диоксид азота + кислород
|
|
|
|
5)
|
нитрит кальция + кислород
|
В4. Установите соответствие названия минерала его формуле
|
|
МИНЕРАЛ
|
|
ФОРМУЛА
|
|
А)
|
каменная соль
|
1)
|
MgCO3
|
|
Б)
|
чилийская селитра
|
2)
|
NaNO3
|
|
В)
|
известняк
|
3)
|
CaSO4·2H2O
|
|
Г)
|
гипс
|
4)
|
NaCl
|
|
|
|
5)
|
CaCO3
|
В5. Установите соответствие между формулой металла и его характеристикой
|
|
МЕТАЛЛ
|
|
СВОЙСТВА
|
|
А)
|
Li
|
1)
|
не реагирует с холодной водой, но реагирует с горячей водой или водяным паром
|
|
Б)
|
Be
|
2)
|
реагирует при комнатной температуре с атмосферным азотом
|
|
Г)
|
Mg
|
3)
|
образует нерастворимый в кислотах гидроксид
|
|
Д)
|
Cs
|
4)
|
проявляет амфотерные свойства
|
|
|
|
5)
|
соли окрашивают пламя в синий цвет
|
В6. Установите соответствие между реагирующими веществами и продуктами взаимодействия
|
|
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
|
|
ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ
|
|
А)
|
Al+KOH+H2O®
|
1)
|
KAlO2+H2
|
|
Б)
|
Al2O3 +KOH+H2O®
|
2)
|
KAlO2+H2O
|
|
В)
|
Al2O3+KOH 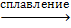
|
3)
|
K[Al(OH)4]
|
|
Г)
|
Al(OH)3+KOH®
|
4)
|
K[Al(OH)4] + H2
|
|
|
|
5)
|
K[Al(OH)4] +H2O
|
В7. Металлический натрий получают из хлорида натрия
|
1)
|
химическим восстановлением из расплава
|
|
2)
|
электролизом расплава
|
|
3)
|
электролизом концентрированного раствора с ртутным катодом
|
|
4)
|
электролизом разбавленного раствора с платиновыми электродами
|
|
5)
|
термическим разложением
|
|
6)
|
окислением из расплава
|
В8. Магний может гореть в
|
1)
|
азоте
|
|
2)
|
углекислом газе
|
|
3)
|
хлоре
|
|
4)
|
неоне
|
|
5)
|
кислороде
|
|
6)
|
водороде
|
В9. Карбонат кальция входит в состав
|
1)
|
глины
|
|
2)
|
известняка
|
|
3)
|
доломита
|
|
4)
|
мела
|
|
5)
|
песка
|
|
6)
|
мрамора
|
В10. Алюминий реагирует при комнатной температуре с
|
1)
|
HNO3(конц.)
|
|
2)
|
H2O
|
|
3)
|
NaOH (водн.)
|
|
4)
|
Br2
|
|
5)
|
S
|
|
6)
|
Fe3O4
|
В11. Полностью разлагаются водой
|
1)
|
Al2S3
|
|
2)
|
Al(NO3)3
|
|
3)
|
Al2(CO3)3
|
|
4)
|
AlCl3
|
|
5)
|
AlPO4
|
|
6)
|
Al2O3
|
В12. Оксид алюминия в природе встречается в виде
|
1)
|
полевого шпата
|
|
2)
|
доломита
|
|
3)
|
рубина
|
|
4)
|
боксита
|
|
5)
|
глинозема
|
|
6)
|
сапфира
|
