
|
Виртуальная химическая школа |
|
Химия+методика+психология водород |



|
ЗАДАНИЯ О чем говорится в следующих фразах: о простом веществе или о химическом элементе? · В состав поваренной соли входит натрий · Хлор раньше применялся в качестве боевого отравляющего вещества · Главный компонент Солнца – это водород. · Нить накаливания в электрических лампах обычно делают из вольфрама · Гремучий газ – это смесь водорода с кислородом в соотношении 2:1 по объему · Алюминий – крылатый металл 2. Установите состав ядер атомов
|
|
ВОДОРОД
Водород H - первый элемент в периодической системе, самый распространённый элемент во Вселенной (92%); в земной коре массовая доля водорода составляет всего 1%. Впервые выделен в чистом виде Г. Кавендишем в 1766 г. В 1787г. А.Лавуазье доказал, что водород - химический элемент. Атом водорода состоит из ядра и одного электрона. Электронная конфигурация - 1S1. Молекула водорода двухатомная. Связь ковалентная неполярная. |
||||||||
|
Изотопы:
|
||||||||
|
Физические свойства.
Водород - газ, бесцветный, без запаха; t°кип = -253°C; t°пл = -259°C; почти не растворяется в воде (в 100V H2O растворяется 2V H2); легче воздуха. D (по воздуху) = 0,069.
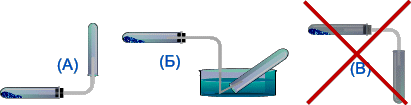
Способы собирания.—вытеснением воздуха и воды |
||||||||
|
|
||||||||
|
Получение
взаимодействие активных металлов с кислотами - неокислителями:
Zn + 2HCl ® ZnCl2 + H2
взаимодействие алюминия (или цинка) с водными растворами щелочей:
2Al + 2NaOH + 6H2O ® 2Na[Al(OH)4] + 3H2
электролиз воды и водных растворов щелочей и солей:
2H2O ® 2H2 + O2 2NaCl + 2H2O ® H2 + Cl2 + 2NaOH
пропускание паров воды над раскалённым углём при 1000°C:
C + H2O « CO + H2
конверсия метана при 900°C: CH4 + H2O « CO + 3H2
Методы (1,2) используют в лаборатории, (3-5) используют в промышленности.
Химические свойства
При обычных условиях малоактивен (реагирует только с фтором)
Восстановительные свойства:
с неметаллами: 2H20 + O2 ® 2H2+1O (со взрывом при поджоге)
H20 + S –150-250°® H2+1S
3H20 + N2 ¬p;t°® 2NH3+1 (в присутствии железного катализатора)
H20 + F2 ® 2HF (со взрывом)
H2 + I2 ¬t°® 2H+1I-1
с оксидами металлов: H20 + СuO –t°® Cu + H2O
(метод получения малоактивных металлов Pb, Mo, W, Ni, Cu и др. из их оксидов)
Окислительные свойства
с щелочными и щелочноземельными металлами:
H20 + 2Li0 ® 2Li+1H-1 H20 + Ca0 ® Ca+2H2-1
Гидриды MeHn - сильные восстановители за счёт водорода в степени окисления (-1). Разлагаются водой и кислотами:
NaH + H2O ® NaOH + H2 CaH2 + 2H2O ® Ca(OH)2 + 2H2 LiH + HCl ® LiCl + H2
Применение
Для промышленного синтеза NH3, HCl, CH3OH (реакцией CO + 2H2 –p;t°;kat® CH3OH)
Восстановление редких металлов из оксидов (W, Mo и др.).
Гидрирование органических соединений (в частности, гидрогенизация растительных масел в твёрдые жиры).
Для сварки и резки металлов водородно-кислородным пламенем. |
||||||||
|
ПЕРОКСИД ВОДОРОДА
Пероксид (перекись) водорода H2O2 открыт в 1818 г. Л. Ж. Тенаром при воздействии разбавленных кислот на BaO2 и получил название "окисленной воды".
Физические свойства
Бесцветная жидкость, которую можно перегонять без разложения при пониженном давлении.
Химические свойства
Разложение: 2H2O2 ® 2H2O + O2
На свету и при нагревании эта реакция может протекать со взрывом; при использовании катализаторов (MnO2, каталаза) этого можно избежать.
Окислительные и восстановительные свойства H2O2.
Получение
Гидролиз его производных:
BaO2 + 2H2O « H2O2 + Ba(OH)2
H2S2O8 + 2H2O « H2O2 + 2H2SO4
Производится почти всегда по второму варианту (электрохимическим способом) из надсерной кислоты, которая получается анодным окислением серной кислоты. Полученные слабые растворы H2O2 концентрируют в керамиковых колоннах. Перекись водорода можно получить основываясь на способности некоторых веществ окисляться при обыкновенной температуре, например, при пропускании О2 в раствор гидразобензола в бензоле получается 94%-ный раствор H2O2 с выходом до 97%.
Применение
Отбеливание шелка, шерсти, пера, мехов, воска и т. п., для реставрации картин (восстановление первоначального цвета красок), в пищевой промышленности для консервации молока, в медицине как дезинфицирующее средство, в химическом производстве, в реактивной технике.
Хранение
В таре из специальных пластмасс или чистого алюминия |
||||||||
|
|
||||||||
|
|
||||||||
|
|
||||||||
|
|
||||||||
|
|
||||||||
|
|
||||||||
|
|