|
Виртуальная химическая школа |
|
Химия+методика+психология
Азот |
АЗОТ
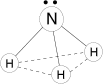
N :NºN:
Открыт Д.Резерфордом в 1772 г. Основной компонент воздуха (78% по объему, 75,6% по массе). В молекуле имеются одна s- и две p- связи.
Физические свойства
Газ, без цвета, запаха и вкуса; плохо растворим в воде (в 100V H2O растворяется 1,54V N2 при t°=20°С и p = 1 атм); t°кип.=-196°C; t°пл.=-210°C.
Получение
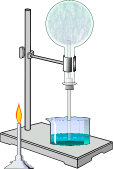
Промышленный способ. Перегонка жидкого воздуха. Лабораторный способ. Разложение нитрита аммония:
NH4NO2 –t°® N2 + 2H2O
Химические свойства
Молекула азота (:NºN:)
Очень устойчива (три ковалентные связи), поэтому обладает низкой реакционной способностью.
Восстановитель N20 ® 2N+2 Высокая температура (электрическая дуга, 3000°С)
N20 + O2 « 2N+2O (в природе - во время грозы)
Окислитель N20 ® 2N-3 c водородом (500°С, kat, p) N20 + 3H2 « 2N-3HЗ
с активными металлами (с щелочными и щел.зем. металлами)
6Li + N20 ® 2LiЗN-3 3Mg + N20 –t°® MgЗN2-3
.
.
|



|
|
АММИАК
NH3
Строение
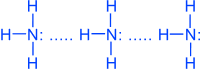
Молекула полярная, имеет форму треугольной пирамиды с атомом азота в вершине, ÐHNH = 107,3°. Атом азота находится в sp3- гибридном состоянии; из четырех гибридных орбиталей азота три участвуют в образовании одинарных связей N–H, а четвертая связь занята неподеленной электронной парой.
Физические свойства
NH3 - бесцветный газ, запах резкий, удушливый, ядовит, легче воздуха. r по воздуху = MNH3 / M ср.воздуха = 17 / 29 = 0,5862 t° кип.= -33,4°C; t°пл.= -78°C. Молекулы аммиака связаны слабыми водородными связями
Благодаря водородным связям, аммиак имеет сравнительно высокие t°кип. и t°пл., а также высокую теплоту испарения, он легко сжимается. Хорошо растворим в воде: в 1V Н2O растворяется 750V NH3 (при t°=20°C и p=1 атм).
В хорошей растворимости аммиака можно убедиться на следующем опыте. Сухую колбу наполняют аммиаком и закрывают пробкой, в которую вставлена трубка с оттянутым концом. Конец трубки опускают в воду и колбу немного подогревают. Объем газа увеличивается, и немного аммиака выйдет из трубки. Затем нагревание прекращают и, вследствие сжатия газа некоторое количество воды войдет через трубку в колбу. В первых же каплях воды аммиак растворится, в колбе создастся вакуум и вода, под влиянием атмосферного давления будет подниматься в колбу, - начнет "бить фонтан".
Получение
Промышленный способ
N2 + 3H2 ® 2NH3 (p=1000 атм; t°= 500°C; kat = Fe + алюмосиликаты; принцип циркуляции).
Лабораторный способ. Нагревание солей аммония со щелочами.
2NH4Cl + Ca(OH)2 –t°® CaCl2 + 2NH3 + 2Н2O (NH4)2SO4 + 2KOH –t°® K2SO4 + 2NH3 + 2Н2O
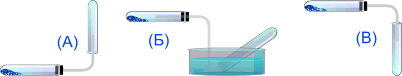
Аммиак можно собирать только по методу (А), т.к. он легче воздуха и очень хорошо растворим в воде.
Химические свойства
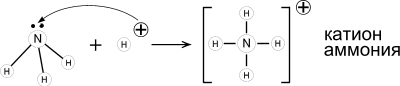
Образование ковалентной связи по донорно-акцепторному механизму.
Аммиак - основание Льюиса. Его раствор в воде (аммиачная вода, нашатырный спирт) имеет щелочную реакцию (лакмус – синий; фенолфталеин – малиновый) из-за образования гидроксида аммония.
NH3 + Н2O « NH4OH « NH4+ + OH-
Аммиак реагирует с кислотами с образованием солей аммония.
NH3 + HCl ® NH4Cl 2NH3 + H2SO4 ® (NH4)2SO4 NH3 + H2O + CO2 ® NH4HCO3
Аммиак - восстановитель (окисляется до N2+1O или N+2O)
Разложение при нагревании 2N-3H3 ¬t°® N20 + 3H2
Горение в кислороде
без катализатора 4N-3H3 + 3O2 ® 2N20 + 6Н2O
каталитическое окисление ( kat = Pt )
4N-3H3 + 5O2 ® 4N+2O + 6Н2O
Восстановление оксидов некоторых металлов
3Cu+2O + 2N-3H3 ® 3Cu0 + N20 + 3Н2O |
|
|
|
|
СОЛИ АММОНИЯ
Соли аммония – сложные вещества, в состав которых входят катионы аммония NH4+, связанные с кислотным остатком.
Физические свойства
Кристаллические вещества, хорошо растворимые в воде.
Получение
Аммиак (или гидроксид аммония) + кислота.
NH3 + HNO3 ® NH4NO3(нитрат аммония) 2NH4OH + H2SO4 ® (NH4)2SO4(cульфат аммония) + 2Н2O
Химические свойства
Сильные электролиты (диссоциируют в водных растворах)
NH4Cl « NH4+ + Cl-
Разложение при нагревании.
если кислота летучая NH4Cl ¬t°® NH3 + HCl NH4HCO3 ® NH3 + Н2O + CO2
если анион проявляет окислительные свойства
NH4NO3 –t°® N2O + 2Н2O (NH4)2Cr2O7 –t°® N2 + Cr2O3 + 4Н2O
С кислотами и солями (реакция обмена)
(NH4)2CO3 + 2НCl ® 2NH4Cl + Н2O + CO2 2NH4+ + CO32- + 2H+ + 2Cl- ® 2NH4+ + 2Cl- + Н2O + CO2 CO32- + 2H+ ® Н2O + CO2
(NH4)2SO4 + Ba(NO3)2 ® BaSO4¯ + 2NH4NO3 2NH4+ + SO42- + Ba2+ + 2NO3- ® BaSO4¯ + 2NH4+ + 2NO3- Ba2+ + SO42- ® BaSO4¯
Соли аммония подвергаются гидролизу (как соль слабого основания и сильной кислоты) – среда кислая:
NH4Cl + Н2O « NH4OH + HCl NH4+ + Н2O « NH4OH + H+
При нагревании со щелочами выделяют аммиак (качественная реакция на NH4+)
NH4Cl + NaOH –t°® NaCl + NH3 + Н2O |
ОКСИДЫ АЗОТА
ОКСИД АЗОТА (I)
ОКСИД АЗОТА (II)
ОКСИД АЗОТА (III)
ОКСИД АЗОТА (IV)
ОКСИД АЗОТА (V)
Оксид азота (I)N2+1O закись азота, "веселящий газ"
Физические свойства
Газ, бесцветный, запах сладковатый, растворим в воде, t°пл.= -91°C, t°кип.= -88,5°С. Анестезирующее средство.
Получение
NH4NO3 –t°® N2O + 2Н2O
Химические свойства
Разлагается при 700°C с выделением кислорода:
2N2+1O –t°® 2N20 + O20
поэтому он поддерживает горение и является окислителем
С водородом: N2+1O + H2 ® N20 + Н2O
Несолеобразующий
Оксид азота (II)N+2O окись азота
Газ, бесцветный, плохо растворим в воде, t°пл.= -164°C, t°кип.= -152°С
Получение
Каталитическое окисление аммиака (промышленный способ)
4NH3 +5O2 ® 4NO + 6H2O
3Cu + 8HNO3(разб.) ® 3Cu(NO3)2 + 2NO + 4H2O
N2 + O2 ® 2NO (в природе, во время грозы)
Химические свойства
Легко окисляется кислородом и галогенами
2NO + O2 ® 2NO2 2NO + Cl2 ® 2NOCl(хлористый нитрозил)
Окислитель 2N+2O + 2S+4O2 ® 2S+6O3 + N20
Несолеобразующий
Оксид азота (III)
N2+3O3 азотный ангидрид
Физические свойства
Темно-синяя жидкость (при низких температурах), t°пл.= -102°C, t°кип.= 3,5°С; Выше t°кип. разлагается на NO и NO2. N2O3 соответствует азотистой кислоте (HNO2), которая существует только в разбавленных водных растворах.
Получение
NO2 + NO « N2O3 Химические свойства
Все свойства кислотных оксидов.
N2O3 + 2NaOH ® 2NaNO2(нитрит натрия) + H2O
Оксид азота (IV)
N+4O2 двуокись азота, диоксид азота
Физические свойства
Бурый газ, запах резкий, удушливый, ядовит, t°пл.= -11,2°C, t°кип.= 21°С.
Получение
2NO + O2 ® 2NO2
Cu + 4HNO3(конц.) ® Cu(NO3)2 + 2NO2 + 2H2O
Химические свойства
Кислотный оксид с водой 2NO2 + H2O ® HNO3 + HNO2 4NO2 + 2H2O + O2 ® 4HNO3
со щелочами 2NO2 + 2NaOH ® NaNO2 + NaNO3 + H2O
Окислитель N+4O2 + S+4O2 ® S+6O3 + N+2O
Димеризация 2NO2(бурый газ) « N2O4(бесцветная жидкость)
Оксид азота (V)
N2+5O5 азотный ангидрид
Физические свойства
Кристаллическое вещество, летучее, неустойчивое.
Получение
2NO2 + O3 ® N2O5 + O2
2HNO3 +P2O5 ® 2HPO3 + N2O5
Химические свойства
Кислотный оксид N2O5 + H2O ® 2HNO3
Сильный окислитель
Легко разлагается (при нагревании - со взрывом):
2N2O5 ® 4NO2 + O2 |
АЗОТИСТАЯ КИСЛОТА
HNO2 Азотистая кислотаH–O–N=O
Физические свойства
Существует только в разбавленных водных растворах.
Получение
AgNO2 + HCl ® HNO2 + AgCl¯
Химические свойства
Слабая кислота; ее соли (нитриты) – устойчивы:
HNO2 + NaOH ® NaNO2 + H2O
Разлагается при нагревании:
3HNO2 ® HNO3 + 2NO + H2O
Слабый окислитель (окислительные свойства проявляет только в реакциях с сильными восстановителями)
2KNO2 + 2KI + 2H2SO4 ® 2K2SO4 + I2 + 2NO + 2H2O Сильный восстановитель:
HNO2 + Cl2 + H2O ® HNO3 + 2HCl АЗОТНАЯ КИСЛОТА
HNO3 Азотная кислота
Физические свойства
Бесцветная жидкость, неограниченно растворимая в воде; t°пл.= -41°C; t°кип.= 82,6°С, r = 1,52 г/см3
Получение
Лабораторный способ
KNO3 + H2SO4(конц) –t°® KHSO4 + HNO3
Промышленный способ. Осуществляется в три этапа:
Окисление аммиака на платиновом катализаторе до NO
4NH3 + 5O2 –500°,Pt® 4NO + 6H2O
Окисление кислородом воздуха NO до NO2
2NO + O2 ® 2NO2
Поглощение NO2 водой в присутствии избытка кислорода
4NO2 + О2 + 2H2O « 4HNO3
Химические свойства
Очень сильная кислота. Диссоциирует в водном растворе практически нацело:
HNO3 « H+ + NO3-
Реагирует:
с основными оксидами CuO + 2HNO3 ® Cu(NO3)2 + H2O CuO + 2H+ + 2NO3- ® Cu2+ + 2NO3- + H2O или CuO + 2H+ ® Cu2+ + H2O
с основаниями HNO3 + NaOH ® NaNO3 + H2O H+ + NO3- + Na+ + OH- ® Na+ + NO3- + H2O или H+ + OH- ® H2O
вытесняет слабые кислоты из их солей
2HNO3 + Na2CO3 ® 2NaNO3 + H2O + CO2 2H+ + 2NO3- + 2Na+ + СO32- ® 2Na+ + 2NO3- + H2O + CO2 2H+ + СO32- ® H2O + CO2
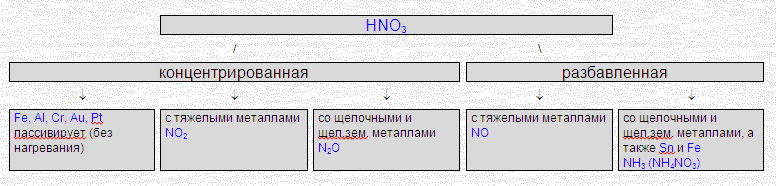
Специфические свойства азотной кислоты
Сильный окислитель
Разлагается на свету и при нагревании
4HNO3 –t°,hn® 2H2O + 4NO2 + O2
Окрашивает белки в оранжево-желтый цвет (при попадании на кожу рук - "ксантопротеиновая реакция")
При взаимодействии с металлами никогда не выделяется водород
металл + HNO3 ® соль азотной кислоты + вода + газ |
|
|
|
HNO3 + 4HCl + Au ® H[AuCl4] + NO + 2H2O "царская водка" С неметаллами: Азотная кислота превращается в NO (или в NO2); неметаллы окисляются до соответствующих кислот:
S0 + 6HNO3(конц) ® H2S+6O4 + 6NO2 + 2H2O B0 + 3HNO3 ® H3B+3O3 + 3NO2 3P0 + 5HNO3 + 2H2O ® 5NO + 3H3P+5O4 РАЗЛОЖЕНИЕ НИТРАТОВ
Реакции разложения нитратов при нагревании
Нитраты щелочных металлов разлагаются до нитритов:
2NaNO3 –t°® 2NaNO2 + O2
Нитраты менее активных металлов (от щелочноземельных до меди) разлагаются до оксидов:
2Mg(NO3)2 –t°® 2MgO + 4NO2 + O2 2Cu(NO3)2 –t°® 2CuO + 4NO2 + O2
Нитраты наименее активных металлов разлагаются до металлов:
Hg(NO3)2 –t°® Hg + 2NO2 + O2 2AgNO3 –t°® 2Ag + 2NO2 + O2
Нитрат аммония разлагаются до N2O
NH4NO3 –t°® N2O + 2H2O |