
|
Виртуальная химическая школа |
|
Химия+методика+психология Химическое равновесие |



|
ЗАДАНИЯ О чем говорится в следующих фразах: о простом веществе или о химическом элементе? · В состав поваренной соли входит натрий · Хлор раньше применялся в качестве боевого отравляющего вещества · Главный компонент Солнца – это водород. · Нить накаливания в электрических лампах обычно делают из вольфрама · Гремучий газ – это смесь водорода с кислородом в соотношении 2:1 по объему · Алюминий – крылатый металл 2. Установите состав ядер атомов
|
|
Обратимые и необратимые химические реакции. Химическое равновесие. Смещение равновесия под действием различных факторов |
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
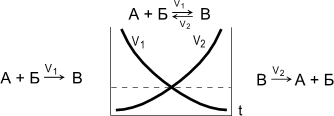
Обратимые реакции - химические реакции, протекающие одновременно в двух противоположных направлениях. |
|
|
|
Химическое равновесие - состояние системы, в котором скорость прямой реакции (V1) равна скорости обратной реакции (V2). При химическом равновесии концентрации веществ остаются неизменными. Химическое равновесие имеет динамический характер: прямая и обратная реакции при равновесии не прекращаются. |
Способы смещения равновесия
Принцип Ле-Шателье. Если на систему, находящуюся в равновесии, производится внешнее воздействие (изменяются концентрация, температура, давление), то оно благоприятствует протеканию той из двух противоположных реакций, которая ослабляет это воздействие |
|
|
|
Давление. Увеличение давления (для газов) смещает равновесие в сторону реакции, ведущей к уменьшению объема (т.е. к образованию меньшего числа молекул). |
|
|
|
Увеличение температуры смещает положение равновесия в сторону эндотермической реакции (т.е. в сторону реакции, протекающей с поглощением теплоты) |
|
|
|
|
|
Увеличение концентрации исходных веществ и удаление продуктов из сферы реакции смещает равновесие в сторону прямой реакции. Увеличение концентраций исходных веществ [A] или [Б] или [А] и [Б]: V1 > V2.
Катализаторы не влияют на положение равновесия.
|
|
|
|
|
V1 |
|
|
A + Б |
« |
В |
|
|
V2 |
|
|
|
V1 |
|
|
|
A + Б |
« |
В |
; увеличение P приводит к V1 > V2 |
|
|
V2 |
|
|
|
2 |
|
1 |
|
|
|
V1 |
|
|
A + Б |
« |
В + Q, то увеличение t°C приводит к V2 > V1 |
|
|
V2 |
|
|
|
V1 |
|
|
A + Б |
« |
В - Q, то увеличение t°C приводит к V1 > V2 |
|
|
V2 |
|