
|
Виртуальная химическая школа |
|
Химия+методика+психология водА |



|
ЗАДАНИЯ О чем говорится в следующих фразах: о простом веществе или о химическом элементе? · В состав поваренной соли входит натрий · Хлор раньше применялся в качестве боевого отравляющего вещества · Главный компонент Солнца – это водород. · Нить накаливания в электрических лампах обычно делают из вольфрама · Гремучий газ – это смесь водорода с кислородом в соотношении 2:1 по объему · Алюминий – крылатый металл 2. Установите состав ядер атомов
|
|
ВОДА
Вода H2O - самое распространённое в природе химическое соединение.
Запасы воды на Земле: в морях и океанах - 1,4 млрд. км3 в ледниках - 30 млн. км3 в реках и озёрах - 2 млн. км3 в атмосфере - 14 тыс. км3 в живых организмах - 65%
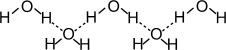
Молекула полярна; угол Вода является дипольным растворителем (растворяет многие газы, жидкие и твёрдые вещества). Между молекулами воды - водородные связи: |
|
|
Аномалии воды
Лёд плавает на поверхности водоёма, r(льда) = 0,92 г/см3, max r(воды) при +4°С = 1г/см3 При замерзании воды происходит расширение объёма. Самая большая теплоёмкость (в 3100 раз больше, чем у воздуха; в 4 раза больше, чем у горных пород).
Кислотно-основные свойства
Слабый электролит: H2O « H+ + OH-
Вода – амфотерное вещество. Она реагирует как с основными оксидами (оксидами щелочных и щелочноземельных металлов), так и с кислотными оксидами (кроме SiO2).
Li2O + H2O ® 2LiOH MgO + H2O ® Mg(OH)2 SO3 + H2O ® H2SO4
Гидролиз некоторых солей приводит к их полному разложению:
Al2S3 + 6H2O ® 2Al(OH)3¯ + 3H2S Al2(CO3)3 + 6H2O ® 2Al(OH)3¯ + 3H2O + 3CO2
Вода разлагает гидриды, фосфиды, карбиды, нитриды и некоторые другие бинарные соединения активных металлов с неметаллами:
CaH2 + 2H2O ® Ca(OH)2 + 2H2 Ca3P2 + 6H2O ® 3Ca(OH)2 + 2PH3 CaC2 + 2H2O ® Ca(OH)2 + C2H2 Ca3N2 + 6H2O ® 3Ca(OH)2 + 2NH3
Молекулы воды с некоторыми солями дают кристаллогидраты:
CuSO4(белый) + 5H2O ® CuSO4 5H2O(синий)
Окислительно-восстановительные свойства
С активными металлами (стоящими в ряду напряжений металлов до Mg включительно) образуется щёлочь и водород, а с металлами средней активности (стоящими в ряду напряжений металлов от Mg до Pb) - оксид и водород:
2Na + 2H2O ® 2NaOH + H2 Ca + 2H2O ® Ca(OH)2 + H2 3Fe + 4H2O –t°® Fe3O4 + 4H2
С галогенами (продукты различны):
4F2 + 3H2O ® OF2+ 6HF + O2 Cl2 + H2O ® HClO + HCl
Вода, в состав которой входит изотоп водорода дейтерий, называется тяжёлой водой D2O |
|
|
|
Химические реакции с тяжёлой водой протекают медленнее, чем с обычной водой. Поэтому D2O накапливается при длительном электролизе H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Физические свойства |
D2O |
H2O |
|
Молекулярная масса |
20 |
18 |
|
Плотность при 20°C (г/см3) |
1,1050 |
0,9982 |
|
t° кристаллизации (°C) |
3,8 |
0 |
|
t° кипения (°C) |
101,4 |
100 |